SLEの治療2020-21
2020年日本リウマチ学会を視聴した(2020、2021年はWeb学会)。全身性エリテマトーデスに関する最新情報をまとめた。さらに、2021年の治療に関する新知見も加えた。
全身性エリテマトーデス(SLE)の診療ガイドライン2019

SLE診療のアルゴリズム
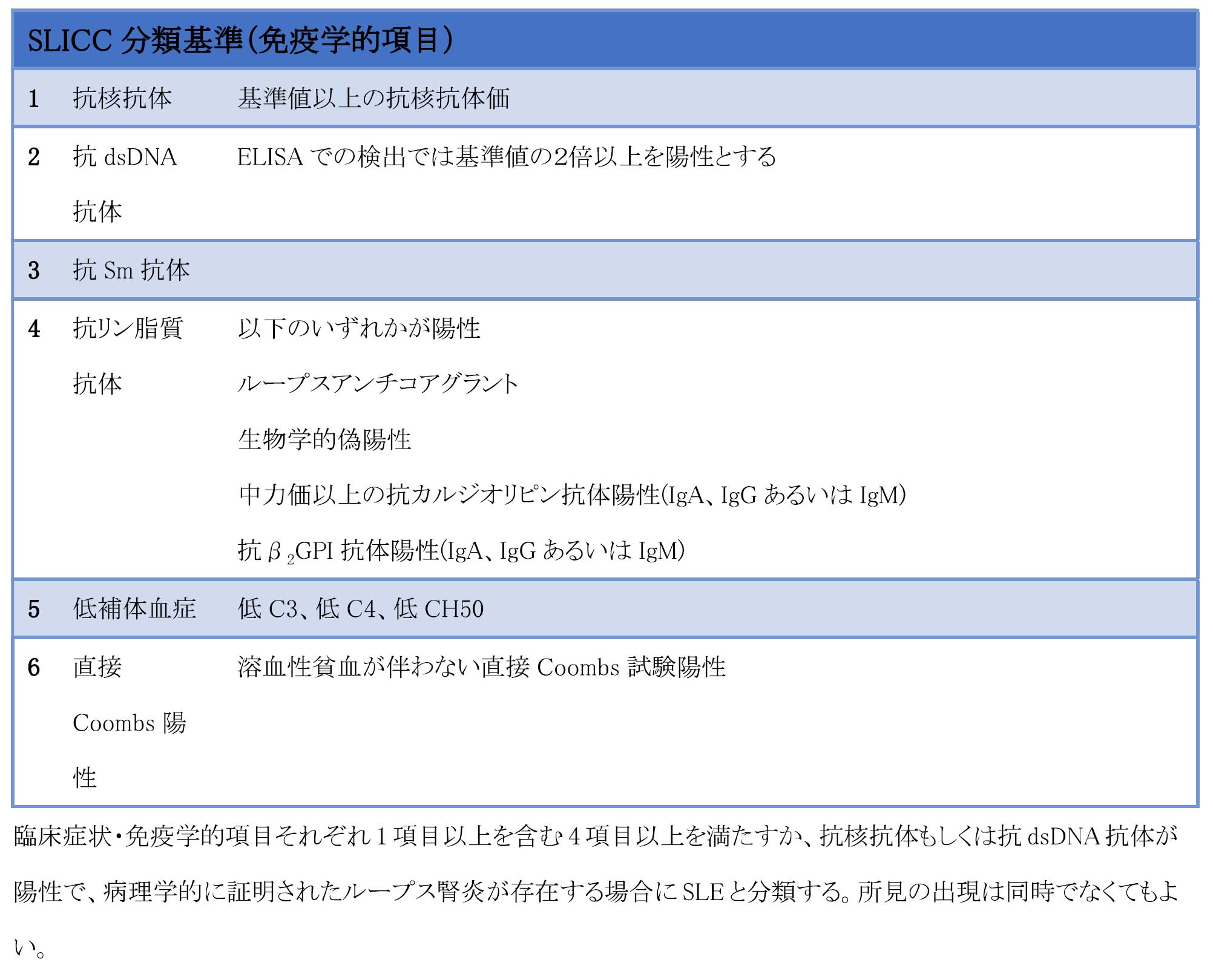
まず、1997年改訂1987年アメリカリウマチ学会(ACR)分類基準と2012年Systematic Lupus Intemational Collaborating Clinics(SLICC)分類基準のいずれかを参考にSLEを診断する。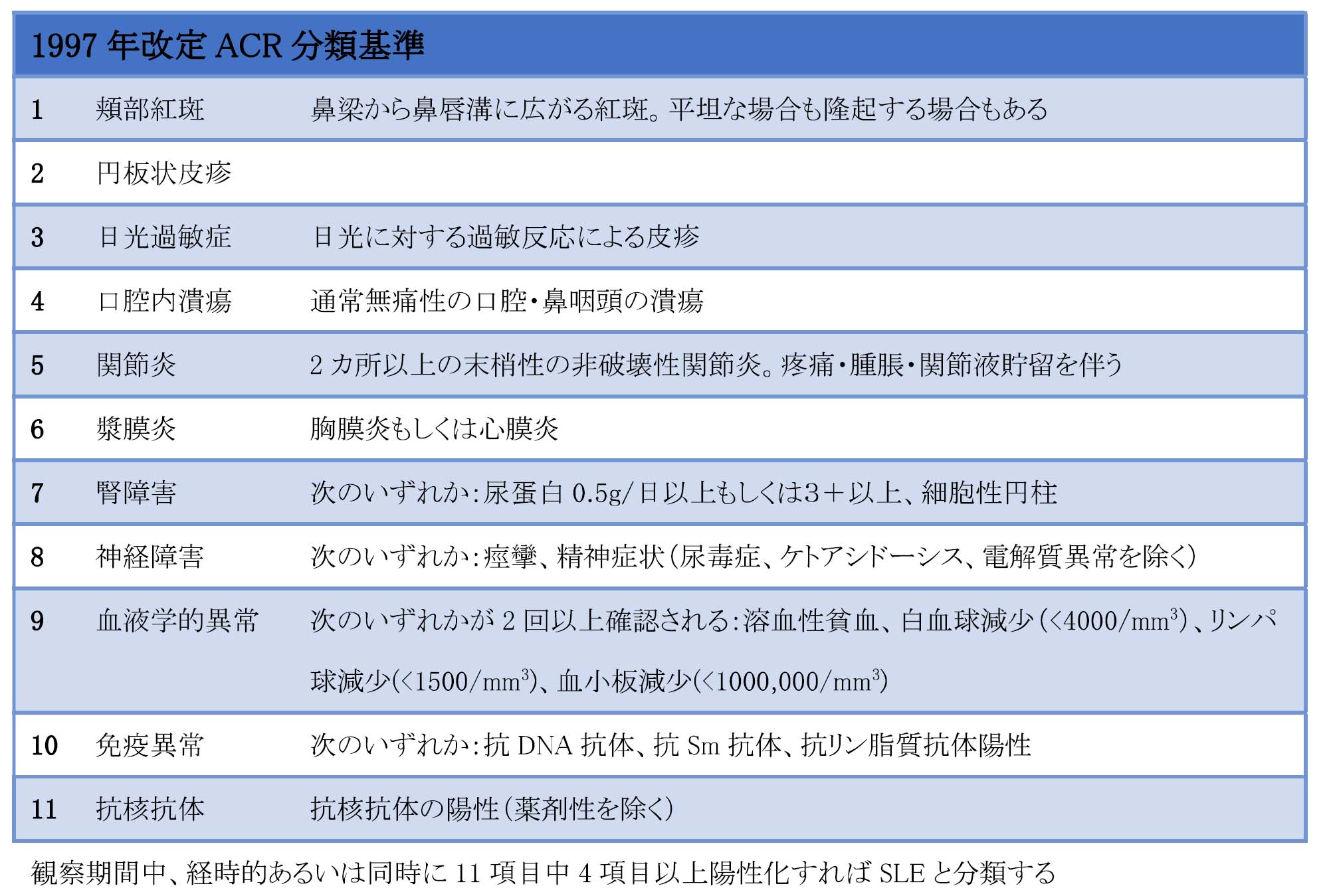

次に、SLEの疾患活動性(臓器病変によってループス腎炎、神経精神ルーブス、それ以外に分けて)を評価し治療を選択する。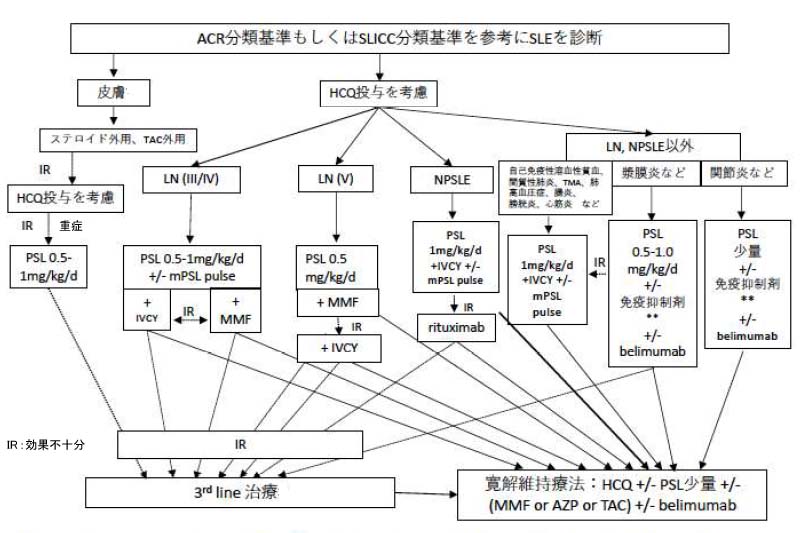
治療薬のうち、ヒドロキシクロロキン(HCQ)は病態や臓器病変に関わらず、禁忌事項に注意しながら全例で投与を考慮する。
皮膚限局SLE
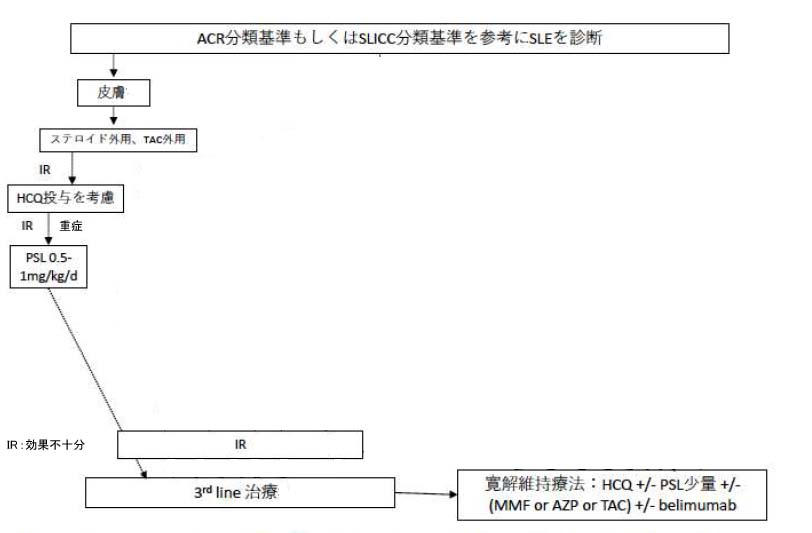
ただし、皮膚に限局する場合はまず外用治療を行い、それに抵抗性の場合にHCQ投与→プレドニゾロン(PSL) 0.5-1.0mg/kg/d投与を考慮する。
ループス腎炎(LN)

LNはInternational Society of Nephrology/Renal Pathology Society(ISN/RPS)分類と基づき寛解導入療法が検討される。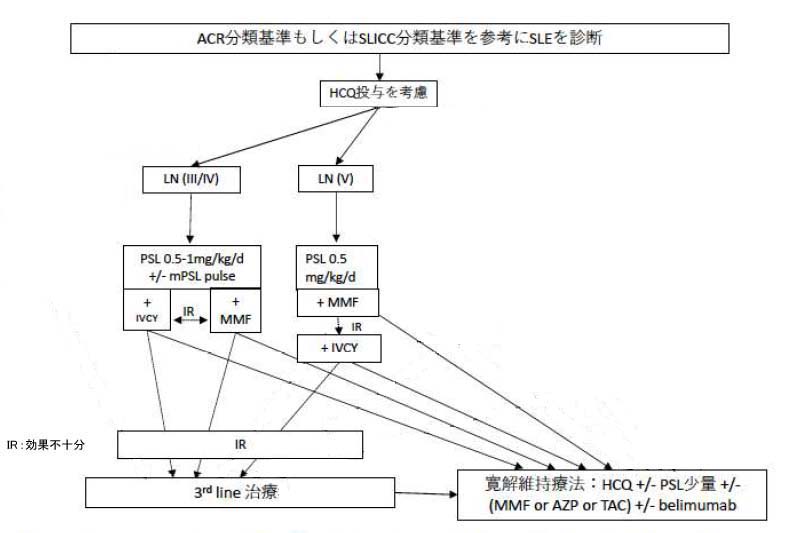
グルココルチコイド(GC; LN III/IV型ではプレドニゾロン(PSL) 0.5-1.0mg/kg/d【メチルプレドニゾロン パルス(mPSL pulse)療法が併用されることがある】、LN V型ではPSL 0.5mg/kg/d)に加えミコフェノール酸モフェチル(MMF)の投与もしくはシクロホスファミド間欠静注療法(IVCY)が選択される。寛解導入されなかった場合には、MMFはIVCYに、IVCYはMMFに変更して再度寛解導入を試みる。寛解維持には、MMFもしくはアザチオプリン(AZP)を主体にタクロリムス(TAC)の投与も検討する。
神経精神ルーブス(NPSLE)
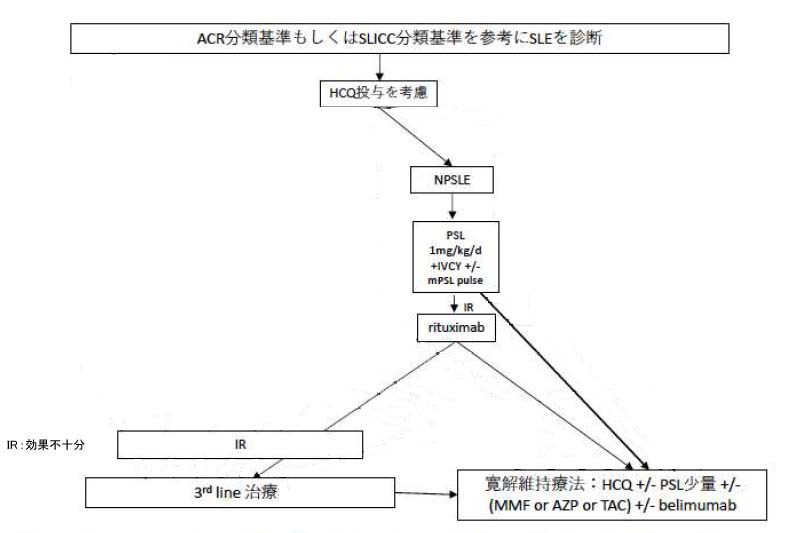
NPSLEにはGC大量療法に加えてIVCYを行う。更にmPSL pulse療法の追加を検討する。治療抵抗例についてはリスクベネフィットを考慮しながらリツキシマブの投与を検討する。
それ以外のSLE
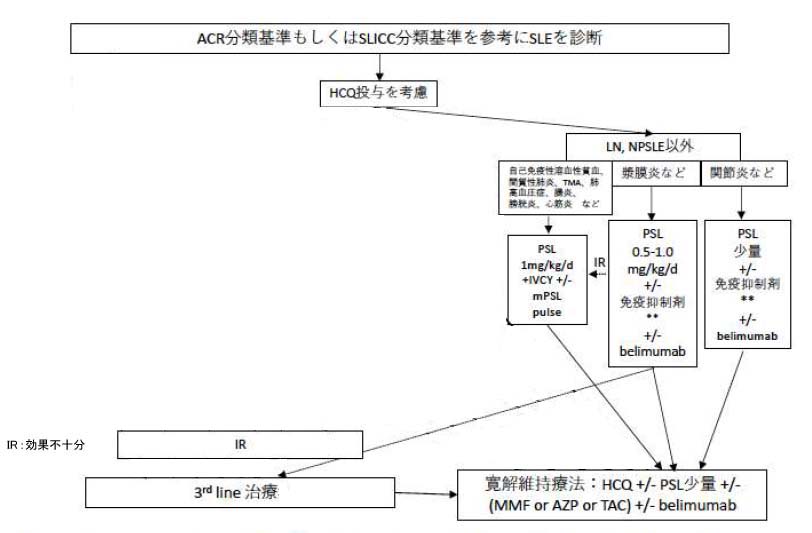
LN、NPSLE、皮疹以外の病態が主症状の場合は、主体となる臓器病変によって治療が異なり以上のようになる。
①自己免疫性溶血性貧血、間質性肺炎、血栓性微小血管障害症(TMA)、肺高血圧症、腸炎、膀胱炎、心筋炎などが主体:GC大量療法(PSL 1mg/kg/d)に加えIVCYやmPSLパルス療法を検討する。
②漿膜炎(胸膜炎・腹膜炎)などが主体:GCに免疫抑制薬(TAC、MMF)の追加を検討する。さらに重症例や治療抵抗例は①の治療内容に準じて治療を行う場合もある。
③関節炎などが主体:少量のGCに免疫抑制薬(メトトレキサート(MTX)、TAC)の追加を検討する。
重症以外の病態でも寛解導入が困難な場合はIVCYを検討する。あるいは、belimumabの併用を検討してもよい。
上記で示された各種治療で寛解導入されなかった場合には3rd lineの治療としてリツキシマブや血漿交換のほか免疫抑制薬(シクロフォスファミド(CY)、ミゾリビン(MZB)、TAC、シクロスポリンA(CsA)、MTX、AZP)の前治療からの変更・追加がおこなわれるが、これらはエビデンスが十分でなくリスクベネフィットを十分に検討することが重要である。寛解導入された後にbelimumabを併用しグルココルチコイドの減量を進めることも検討する。
グルココルチコイド早期減量の試み
SLE患者に認められるダメージは、早期にはSLE自体によるものが多いが、時間が経つにつれてグルココルチコイド(コルチコステロイド)に関連するものが増えてくる。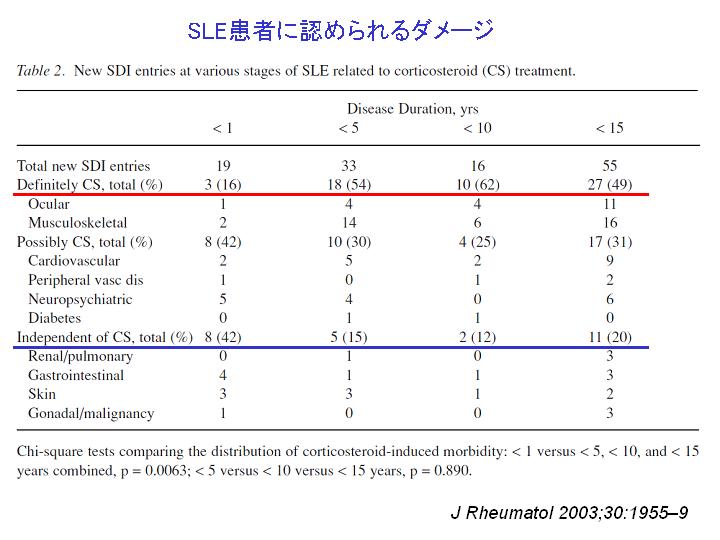
ループス腎炎においてグルココルチコイドだけで治療される患者数は年々減少してきている。免疫抑制剤を併用し、早期にグルココルチコイドを減量しようとする傾向が増加してきている。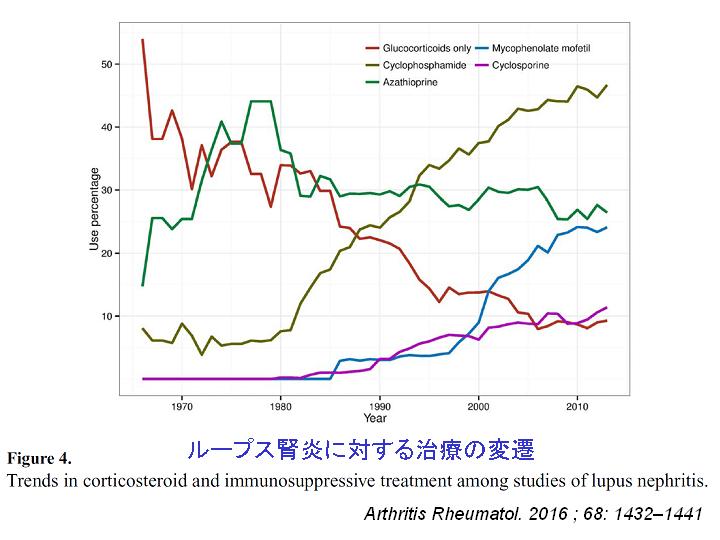
全身性エリテマトーデスに対する治験進行中の新規治療
ベリムマブ
ベリムマブは現在全身性エリテマトーデスに保険適応があるが、ループス腎炎(LN)に対する有効性は今まで検討されていなかった。以下の論文(N Engl J Med 2020;383:1117-28)でベリムマブ+標準治療が標準治療単独と比べ有意にLNの腎反応を改善させることが示された。

自己抗体陽性で臨床的活動性ループス腎炎を有する18歳以上のSLE患者448例を無作為化して、標準治療+ベリムマブ群(ベリムマブ併用群:224例)、又は標準治療+ブラセボ群(プラセボ併用群:224例)に1:1で割リ付け、標準治療に上乗せして、二重盲検下でベリムマブ 10mg/kg又はプラセボを初回、2週間後、4週間後、以降は4週間ごと100週時まで静脈内投与し104週間観察した。
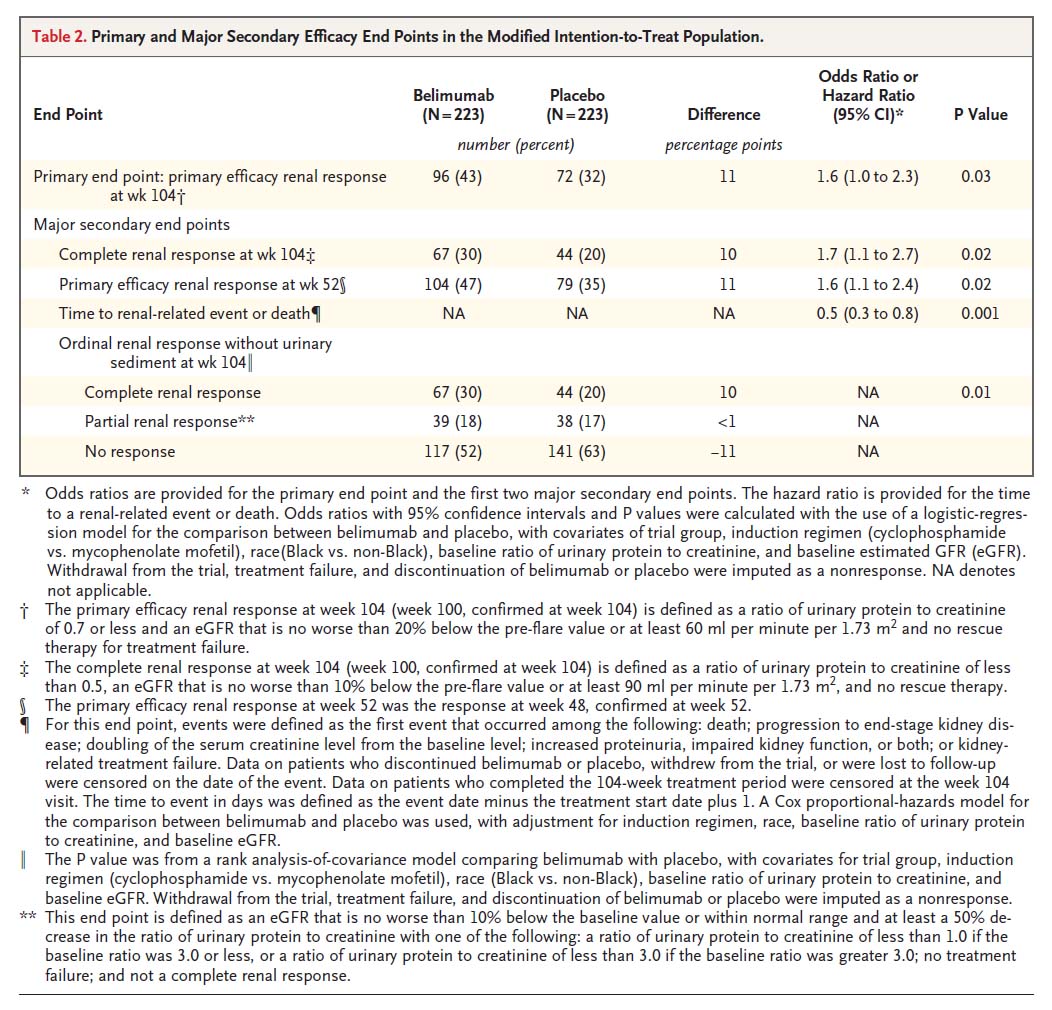
主要評価項目である104週目でのprimary efficacy renal response(PERR:2回連続で以下の3項目をすべて満たす場合)はベリムマブ併用群で43%であったのに対し、プラセボ併用群では32%であった(有意差あり)。
PERR
①クレアチニンに対する尿中タンパク質の比率が0.7以下
②推定糸球体濾過率[eGFR]は、腎フレア前の値より20%以上低下しない、もしくは、eGFR 60ml/min/1.73m2以上
③レスキュー療法の使用なし
主要な二次評価項目であるComplete renal response(CRR:2回連続で以下の3項目をすべて満たす場合)はベリムマブ併用群で30%であったのに対し、プラセボ併用群では20%であった(有意差あり)。
CRR
①クレアチニンに対する尿中タンパク質の比率が0.5以下
②推定糸球体濾過率[eGFR]は、腎フレア前の値より10%以上低下しない、もしくは、eGFR 90ml/min/1.73m2以上
③レスキュー療法の使用なし
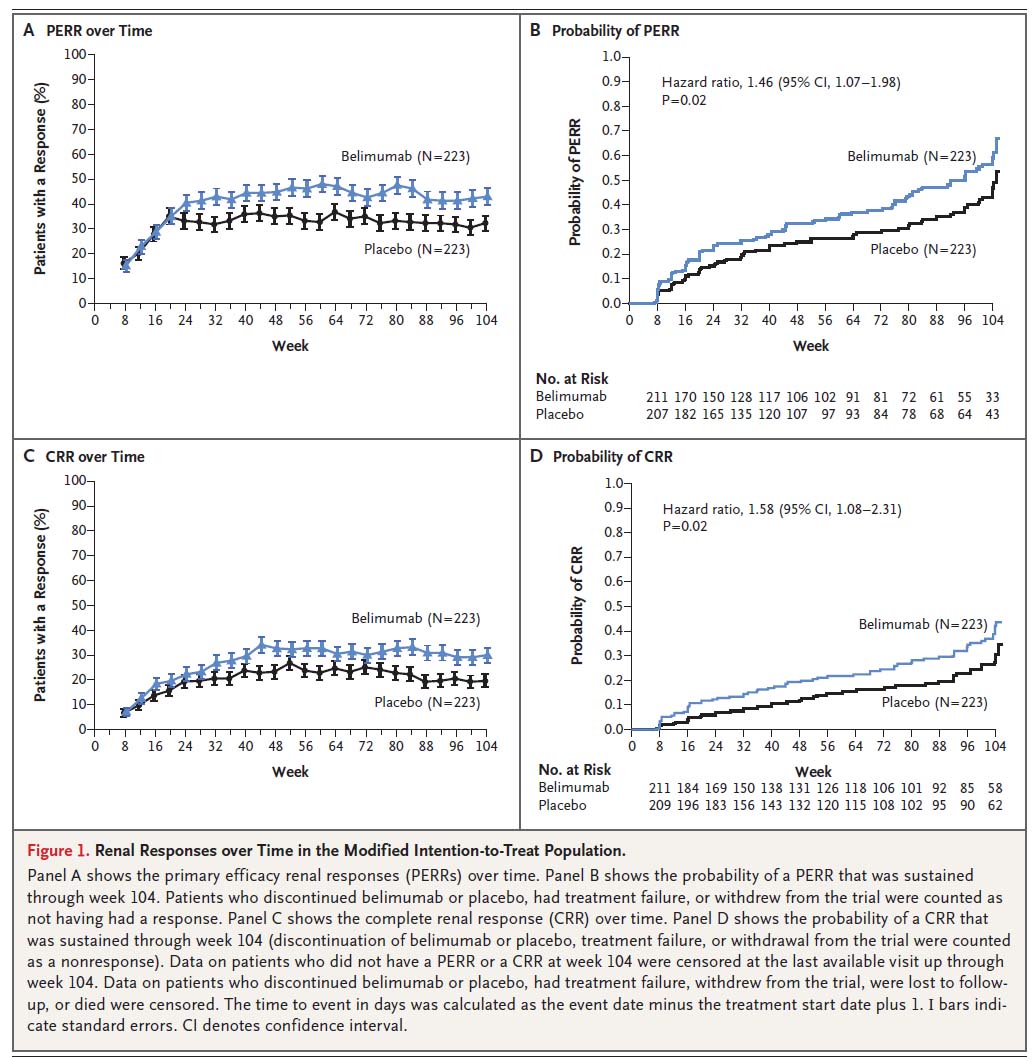
primary efficacy renal response(PERR)とComplete renal response(CRR)の達成率の推移(over Time)、達成までの時間(Probability)を示す。
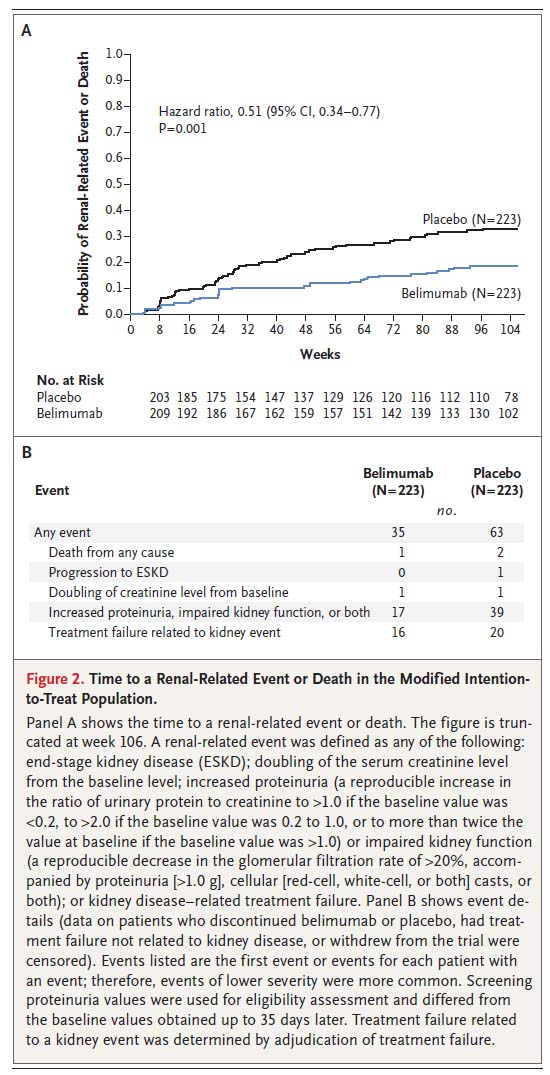
腎関連イベントまたは死亡のリスクは、ベリムマブを投与された患者の方がプラセボを投与された患者よりも低かった(ハザード比、0.51; 95%CI、0.34-0.77; P = 0.001)。
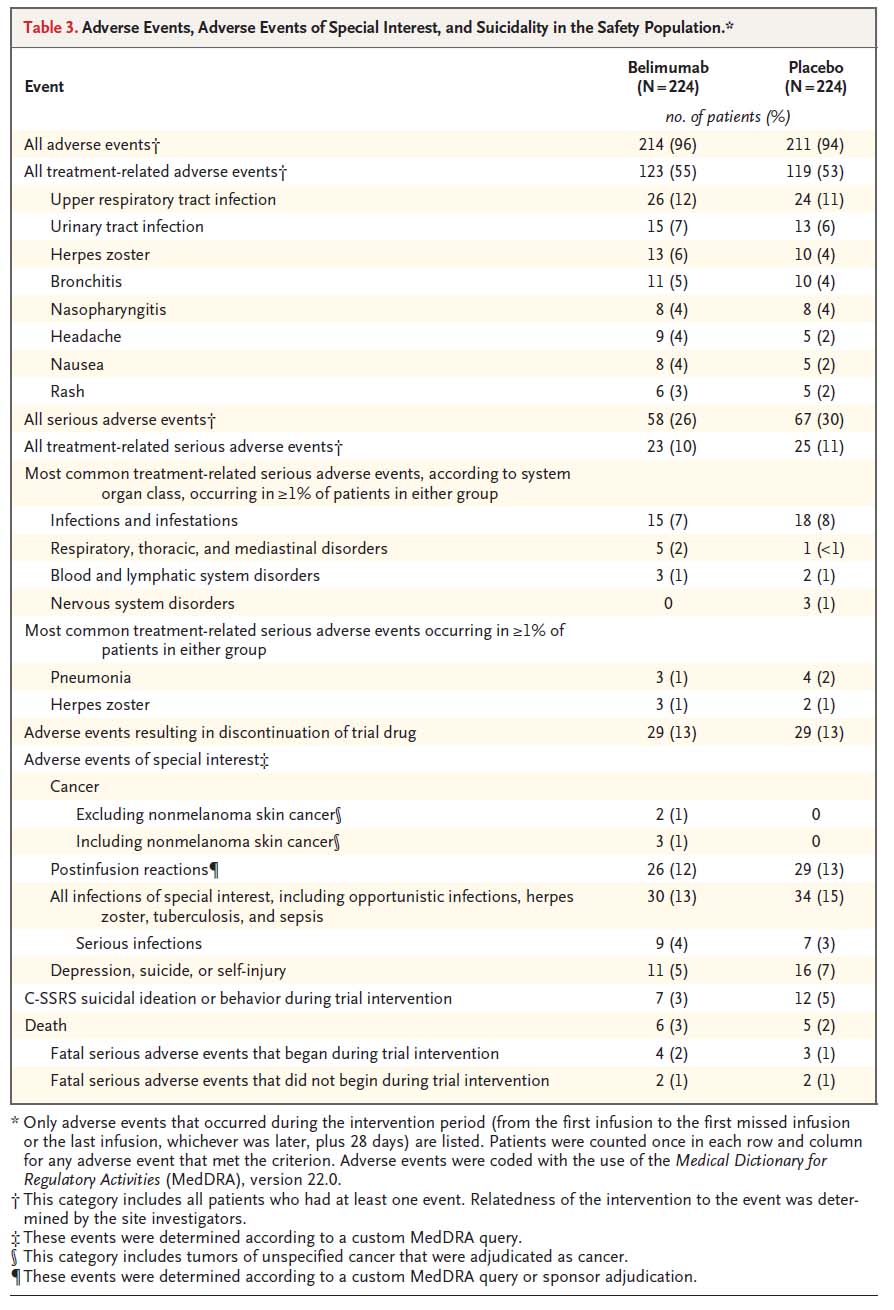
安全性:有害事象に関しては、ベリムマブ併用群とプラセボ併用群と比べると大きな差はなかった(ベリムマブ併用群では悪性腫瘍が3例見られ、プラセボ併用群では0例というのは気になるが)。
Anifrolumab
Anifrolumabはtype I interferon receptor subunit 1に対するヒトモノクローナル抗体である。300mg/月点滴静注。
2021/7/30 米国食品医薬品局(FDA)はSLEに対し、anifrolumab(Saphnelo)を承認した。
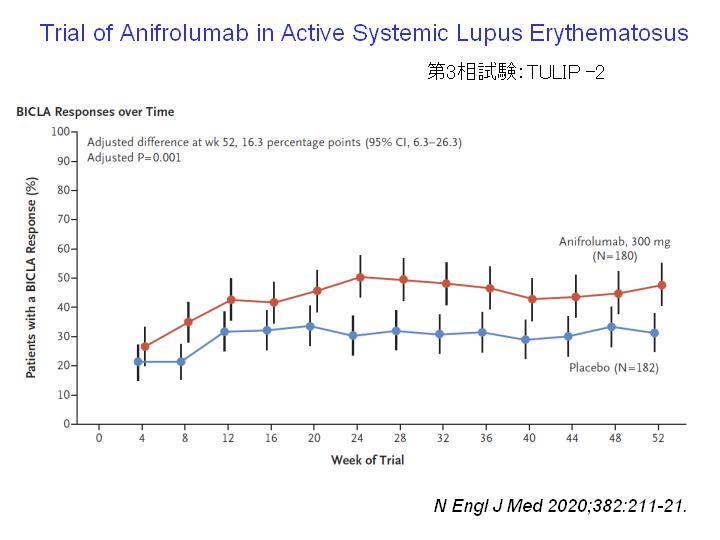

Anifrolumab投与により、プラセボと比較したところ、BICLAというSLE活動性指数が52週後に有意に低下していた。
バリシチニブ
関節リウマチ、アトピー性皮膚炎、SARS-CoV-2による肺炎(ただし、酸素吸入を要する患者に限る)に保険適応のあるJAK阻害剤であるバリシチニブ 4mgは全身性エリテマトーデスにも有効である(SLEの活動性指標:SLEDAI-2K、SRI-4)。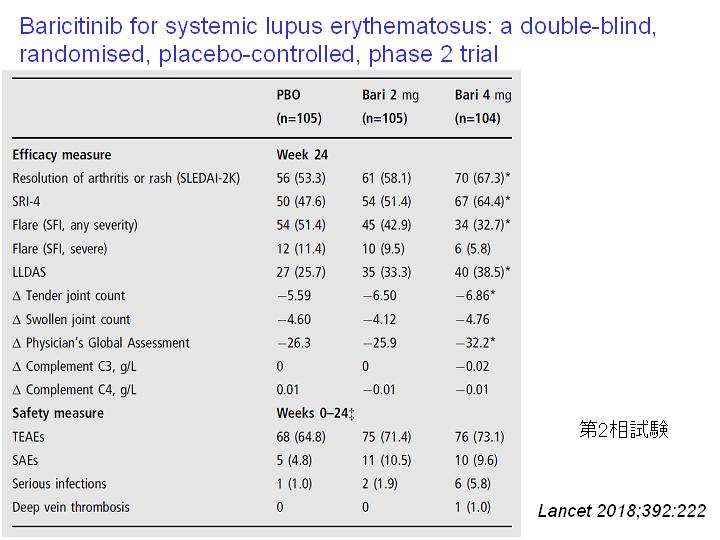
Voclosporin
Voclosporinは新たに開発されたカルシニューリン阻害剤(シクロスポリンやタクロリムスの仲間)である。Voclosporin + MMF群では52週時点でのループス腎炎の腎機能改善度がMMF単独群に比べ有意な改善が認められた。
2021/1/22 FDAはループス腎炎に対し、voclosporin(Lupkynis)を承認した。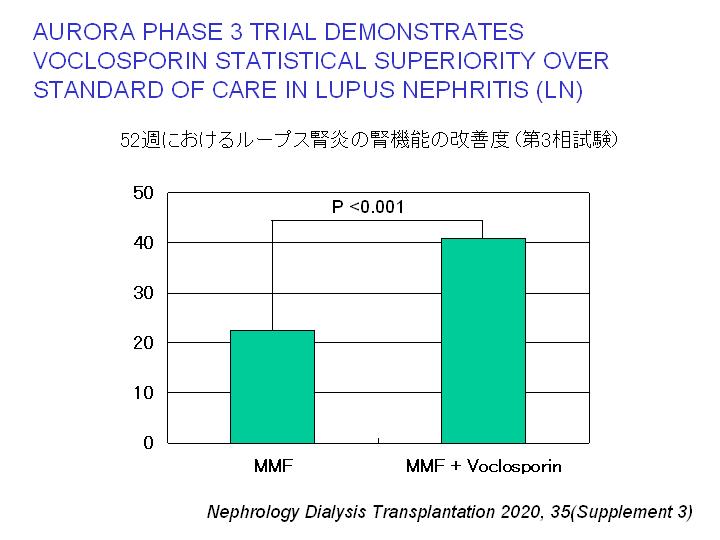
Lancet 2021 May 29;397(10289):2070-2080.
Obinutuzumab(オビヌツズマブ)
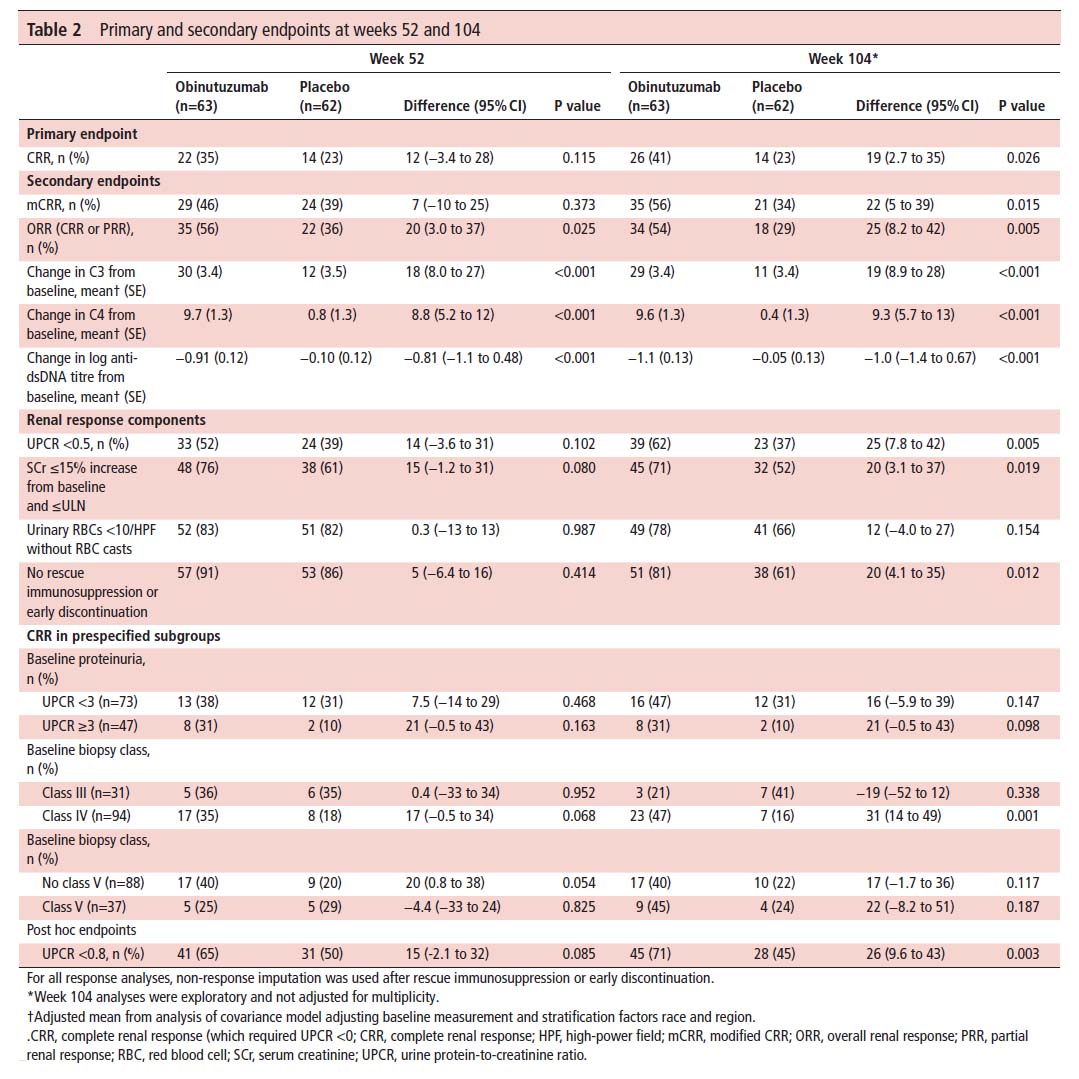
Obinutuzumabは抗CD20モノクローナル抗体で、投与すると迅速に血中のBリンパ球数が減少する。Obinutuzumab + MMF群では104週時点でのループス腎炎(III/IV型)の腎機能改善度がMMF単独群に比べ有意な改善が認められた(Ann Rheum Dis 2021;0:1-8. doi:10.1136/annrheumdis-2021-220920)。
Obinutuzumab(Gazyva)はFDAにて、慢性リンパ球性白血病(2013年)、folicular lymphoma(2017年)に対し承認されている。日本でも2018年にCD20陽性の濾胞性リンパ腫に対し、保険適応となっている。

I型抗CD20抗体であるリツキシマブとオクレリズマブのランダム化試験では、増殖性ループス腎炎(LN)に対し有効性を示せなかった。強力なB細胞枯渇を誘発するヒト化II型抗CD20モノクローナル抗体であるオビヌツズマブを、標準治療と組み合わせたLN治療のためのプラセボと比較した。
ミコフェノール酸とコルチコステロイドを投与されているLN患者は、1日目と2、24、26週目にオビヌツズマブ1000mgまたはプラセボにランダム化され、104週目まで追跡された。主要評価項目は52週目までの完全腎反応(CRR)であった。
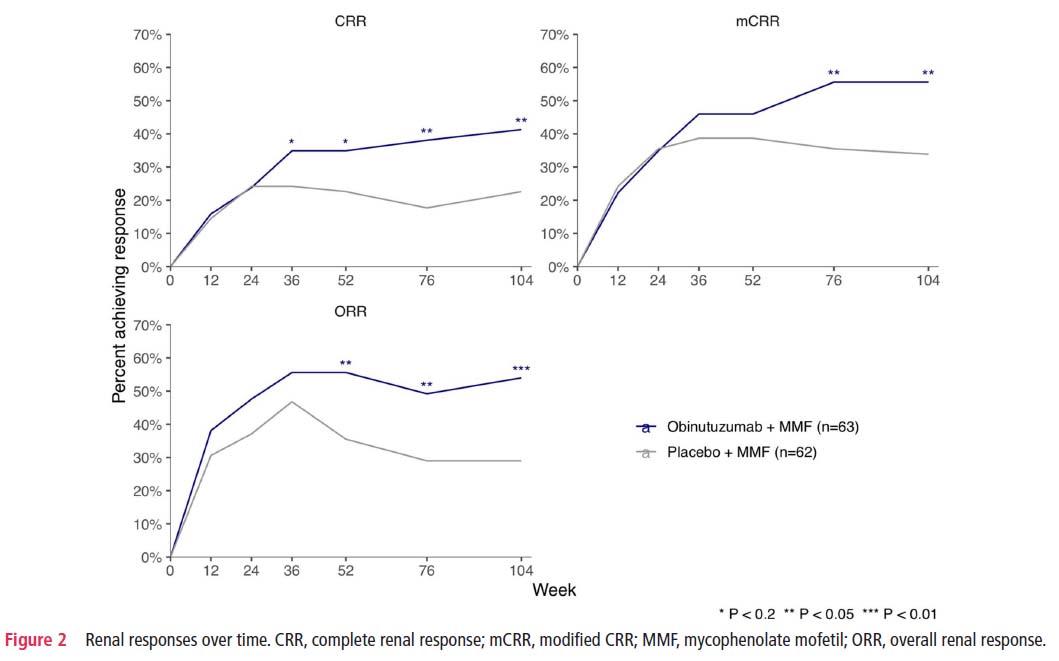
Complete renal response (CRR)
①クレアチニンに対する尿中タンパク質の比率が0.5以下
②ベースラインの血清クレアチニンに比べ、15%以上悪化させることなく正常な腎機能(血清クレアチニン:正常上限以下)を維持している事
③沈渣で赤血球が10/high-power field (HPF) 未満、かつ赤血球円柱なし
④レスキュー療法(cyclophosphamide, rituximab, tacrolimus, ステロイドパルス療法)の使用なし
Overall renal response (ORR)
CRRまたはPRRを達成した患者の割合
Partial renal response (PRR)
①クレアチニンに対する尿中タンパク質の比率がベースラインに比べ50%減少し、クレアチニンに対する尿中タンパク質の比率が1以下となる(ただし、ベースラインのクレアチニンに対する尿中タンパク質の比率が3以上の場合は、3未満となった場合)
②血清クレアチニンがベースラインから15%を超えて増加していない
③沈渣で赤血球が10/high-power field (HPF) 未満、またはベースラインに比べ増加が50%以下にとどまる
modified CRR(mCRR)
①クレアチニンに対する尿中タンパク質の比率が0.5以下
②血清クレアチニン:正常上限以下
合計125人の患者がエントリーした。 CRRの達成率は、52週目のオビヌツズマブ群で35%、プラセボ群で23%、104週ではそれぞれ41%、23%で、オビヌツズマブ群で有意な達成率の増加が認められた。ORR、mCRRでも同様な傾向であった。
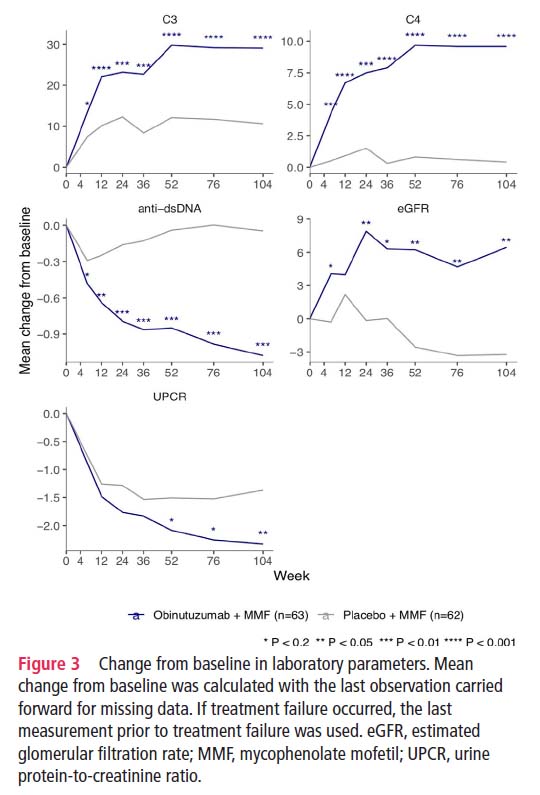
C3、C4、抗ds-DNA抗体、eGFR(推定糸球体濾過率)、UPCR(クレアチニンに対する尿中タンパク質の比率)においても、プラセボ群に比べ、オビヌツズマブ群で有意な改善が認められた。
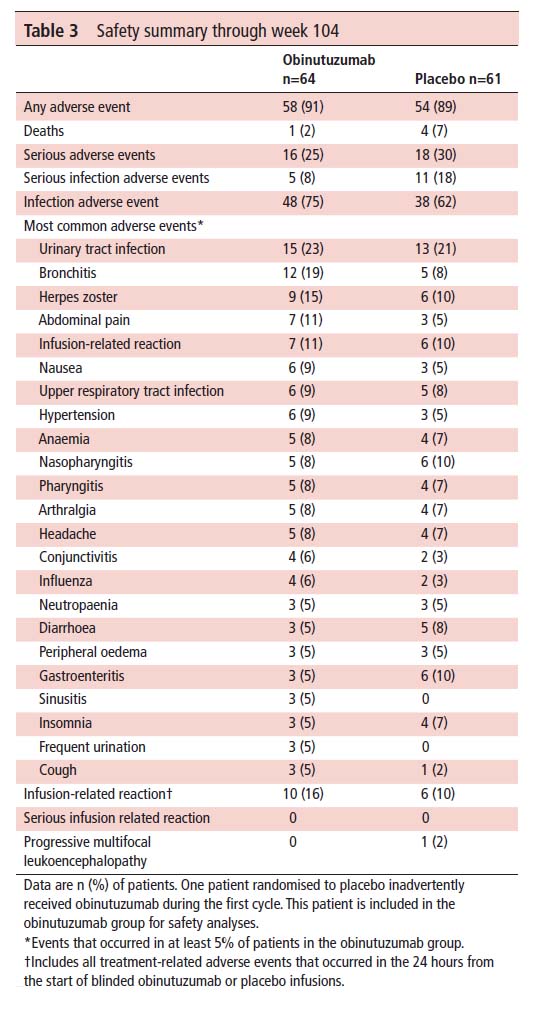
安全性に関しては、オビヌツズマブは、プラセボと比較して重篤な有害事象、重篤な感染症または死亡の増加とは関連していなかった(感染症がやや多い気がするが)。非重篤な投与部位反応は、オビヌツズマブでより頻繁に発生した。
セクキヌマブ(商品名:コセンティクス)
尋常性乾癬、関節症性乾癬、膿疱性乾癬、強直性脊椎炎、体軸性脊椎関節炎に保険適応のあるJ抗IL-17A抗体であるセクキヌマブはループス腎炎にも有効であると報告されている。

Cureus 13(8): e17198. DOI 10.7759/cureus.17198, 2021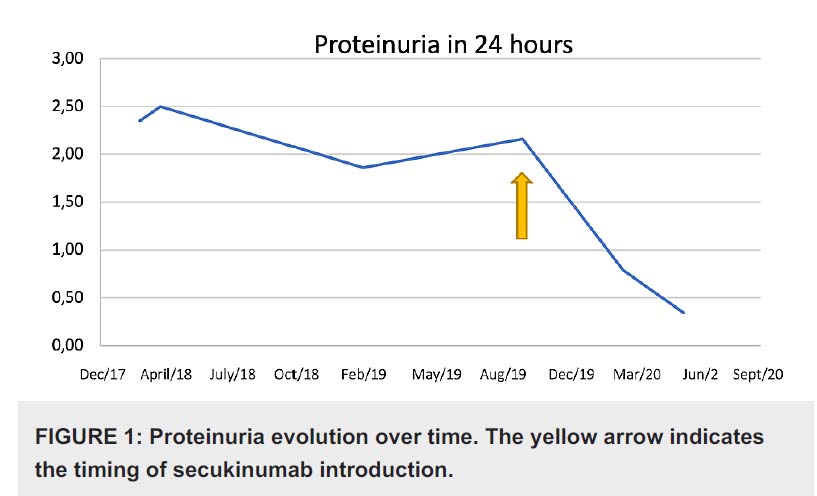
ループス腎炎に対するセクキヌマブの有効性、安全性を調べる第III相試験が進行中である。
関連ページ
- 全身性エリテマトーデスの診断
- 全身性エリテマトーデスの診断について説明します。
- 全身性エリテマトーデスの治療
- 全身性エリテマトーデスの治療について説明します。