心房細動
2025年5月1日18:30過ぎ坐禅会に参加している時に坐禅をしているにもかかわらず何とも言えぬ違和感を自覚しました。その後も違和感を自覚したまま就寝しました。翌朝出勤して、院長室で静かにしている時にアップルウオッチに心房細動の警告が出現しました。アップルウオッチでの心電計で確認すると心房細動の波形でした。
11時で診療を終了とし、近くの循環器科専門医に受診しました。12誘導の心電図をとってもらったところ、やはり心房細動でした。心臓のエコーを施行してもらいましたが、見える範囲では血栓がないということで安心しました。すぐに浜松医大循環器科に受診するように指示され、浜松医大へと向かいました。血液検査、心電図、胸部X検査の結果、以下の理由で、すぐに除細動をする必要はないという結果になりました。
(1)心電図のF波の振幅が大きくないため、初発の心房細動ではない可能性がある。
(2)D-Dimerは正常値であるが、fibrinogenがやや上昇している事より、既に血栓が生じている可能性がある。
(3)抗凝固療法を行っていない状況で、除細動を行うと塞栓症を起こす危険性がある。
(4)心不全やショック状況ではなく、緊急で除細動を行う必要はない。
(5)今後自然に洞調律に戻る可能性がある。
抗凝固剤(イグザレルト)を処方され帰宅しました。5/4朝目覚めると胸の違和感がなくなっていました。アップルウオッチでの心電計を確認すると洞調律に戻っていました。
7/14午後5時頃2回目の心房細動発作が出現しました。脈拍数が増加しないようにするためワソラン(喘息があるため、βブロッカーは使いたくないという理由で)を内服しました。その後、約24時間で洞調律に戻りました。12/17に3回目の心房細動発作が出現し、この時も24時間で洞調律に戻りました。12/25浜松医大循環器科に受診し、2026年2月24日心臓カテーテルによるアブレーション治療を行うこととなりました。今回は発作性心房細動ということになります。そこで心房細動について、2023年米国、2024年ヨーロッパ(ESC)の最新のガイドラインを中心にまとめてみました。
【1】心房細動の疫学
心房細動の有病率は、一般人口の2%(日本人の有病率は0.6~1.1%)で、年齢が上がるにつれて発生率が増加します。80歳以上では10-12%の有病率といわれています。心房細動の有病率は年々増加しており、米国では約610万人の成人(世界では約5,000万人)が罹患しており、2030年までに2倍に増加すると予測されています。
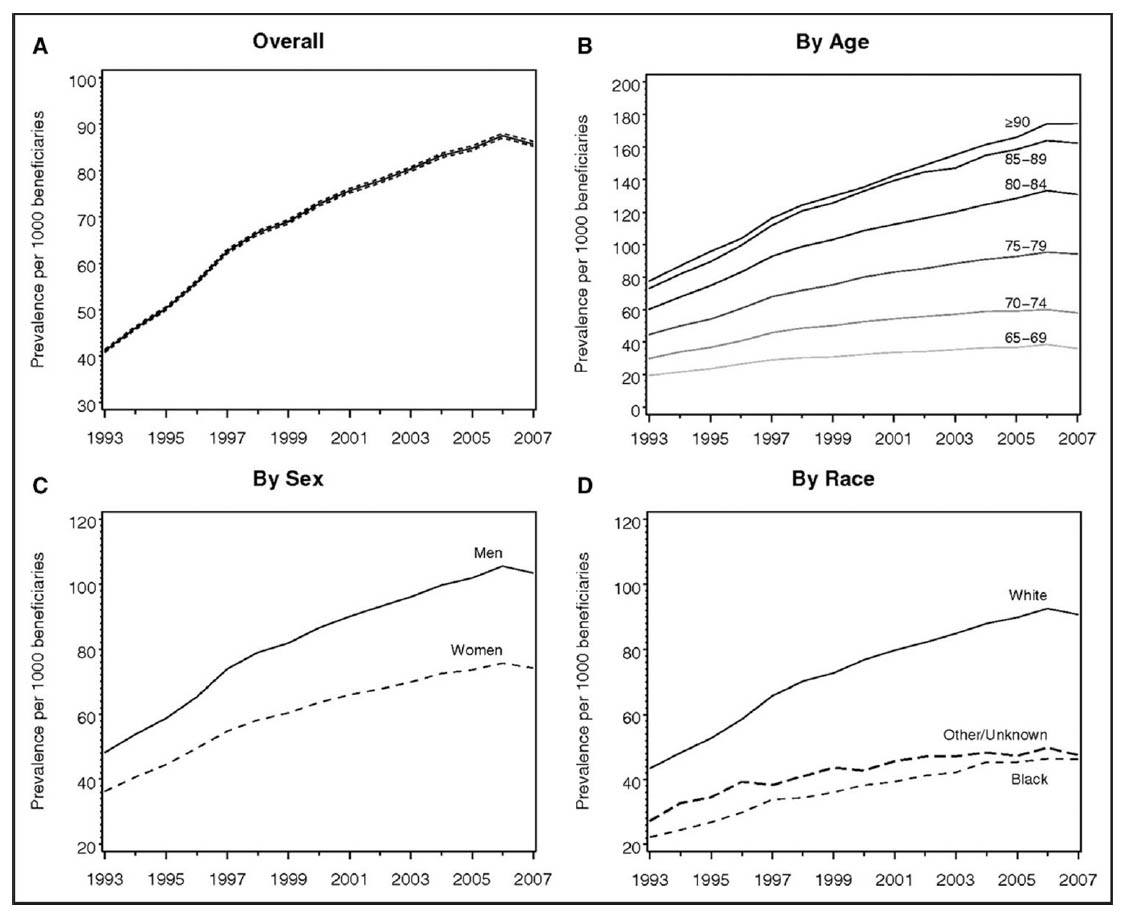
1993年から2007年における米国のメディケア受給者における心房細動の有病率。
(A)全体のコホート、(B)年齢層別、(C)性別別、(D)人種別。 文献1】より
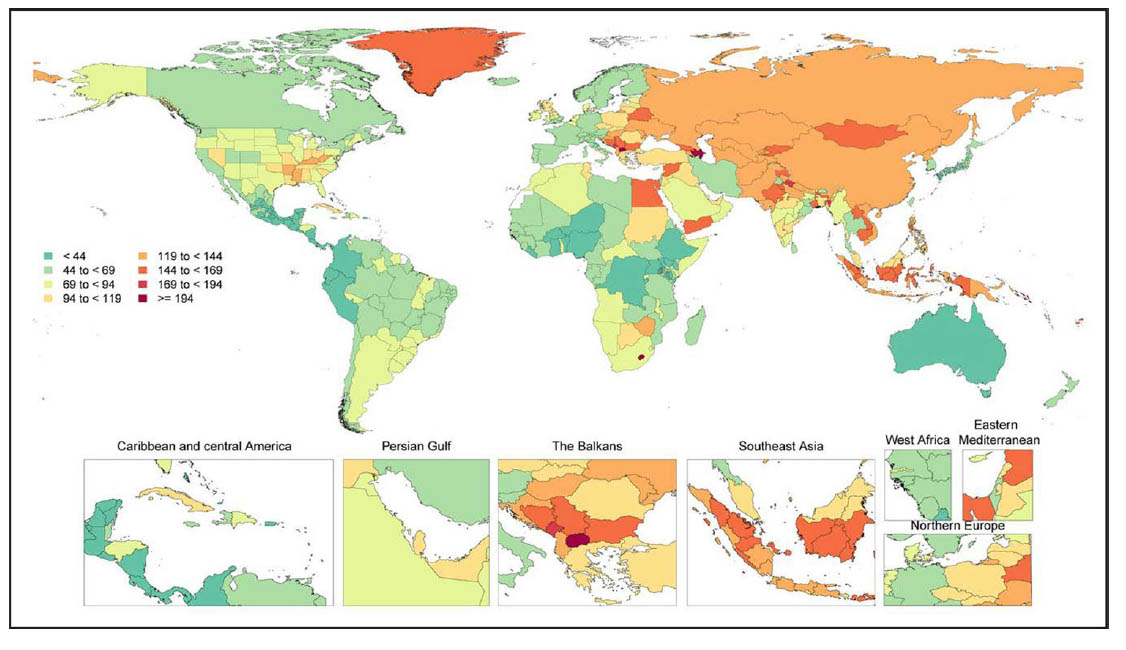
2020年世界各国の100,000人あたりの心房細動および心房粗動の年齢標準化された有病率。文献1】より
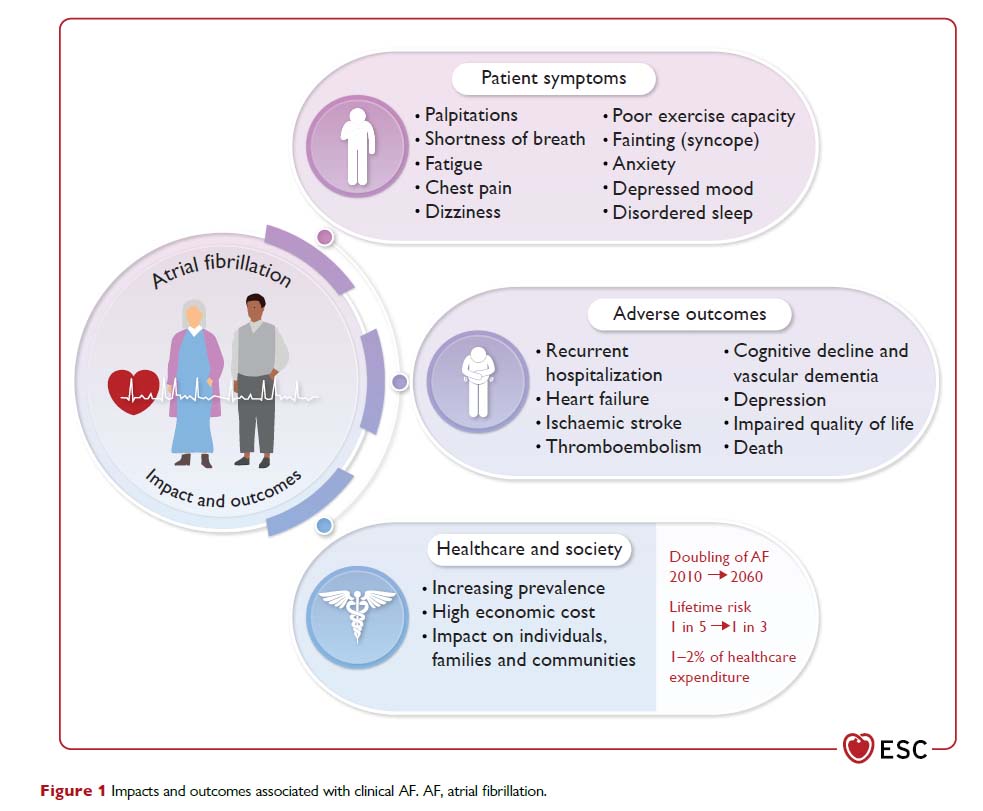
【2】心房細動に起因する症状
心房細動のエピソードに関連する症状はさまざまで広範であり、動悸、息切れ、易疲労感、胸部不快感などが認められます。ただし、心房細動患者の半数は無症候性に発症する可能性があります。私の場合も心房細動が発症したときは動悸はなく、アップルウオッチの警報で心房細動であることが判明しました。アップルウォッチを用いたApple Heart Study では,不整脈通知を受けた者の34%で心房細動が確認され,陽性適中率は84%という報告があります。症状の有無は、脳卒中、全身性塞栓症、または死亡率とは関係ありません。しかし、症状は患者の生活の質に影響を与えます。心房細動の患者は、不安の負担とうつ病の重症度が高いと報告されています。
 文献2】より
文献2】より
【3】心房細動に関連する合併症
心房細動は、さまざまな重篤な合併症が生じます。心房細動により、死亡リスクは1.5倍から2倍の増加するといわれています。2017年心房細動による死亡者数は全世界で25万人を超えていました。心房細動患者に最も一般的な合併症は心不全であり、時間の経過とともに患者の約半数に発生します。心房細動の患者は、心房細動のない患者と比較して心不全の相対リスク(RR)が4倍から5倍に増加することが、2つのメタアナリシスで示されています(RR、4.62;95%CI、3.13-6.83およびRR、4.99;95%CI、3.0-8.22)。次に多い合併症は、脳梗塞(RR、2.3;95%CI、1.84-2.94)、心筋梗塞や狭心症などの虚血性心疾患(RR、1.61;95%CI、1.38-1.87)です。心房細動の患者は、認知症/認知障害のリスクも1.5倍と高くなっています。また、心房細動は心臓突然死のリスクが2倍、慢性腎臓病のリスクが1.6倍、末梢動脈疾患のリスクは1.3倍それぞれ増加させると報告されています。
【4】心房細動に対する検査
心房細動の診断には12誘導心電図が必須であり、RR間隔の絶対不整と不規則に上下に変動し細かく揺れる基線(fibrillation波;F 波)が記録されます。永続性の心房細動になると、F波が小さくなり、はっきり認識できないことがあります。さらに、12誘導心電図は、心臓肥大のチェック、構造的心疾患、伝導障害、虚血の兆候を探すために必要です。血液検査(腎機能、血清電解質、肝機能、全血球数、血液凝固検査、HbA1c、甲状腺検査)を実施して、心房細動を悪化させたり、出血や血栓塞栓症のリスクを高めたりする可能性のある因子を検出する必要があります。経胸壁心エコー図は、心血管の徴候や構造を評価するために実施する必要があります。
ヨーロッパのガイドラインでは、必要な患者では下記の検査を追加する事を推奨しています。
・心血管疾患の状態と脳卒中/出血リスクの評価のためのさらなる血液検査(例: NT-proBNP、トロポニン)
・左心房血栓および弁膜症評価のための経食道心エコー検査
・虚血性心疾患が疑われる場合、冠動脈CT、血管造影、心筋シンチ
・心房および心室性心筋症の評価のための心臓MRI
・脳血管障害/認知症の評価のための頭部CT、MRI
【5】心房細動の分類
1)最初に診断された心房細動
以前に診断されたことがなく、心電図上はじめて心房細動が確認されたもので、症状の状態、持続時間に関係ありません。その後の経過により以下に分類されます。
2)発作性心房細動
7日以内に自然に洞調律に戻ったり、または治療(薬物、電気的除細動を問わず)によって洞調律に戻る心房細動。
3)持続性心房細動
心房細動発症後7日を超えて持続するもの。7日目以後に薬物または電気的除細動によって洞調律に戻る場合も含みます。
4)長期にわたる持続性心房細動
12か月以上の持続性心房細動として定義されます。
5)永続性心房細動
心房細動であることが患者および医師により受容されている場合で、洞調律への回復をこれ以上患者も医師も計画していない状態です。洞調律への復帰を考慮する場合には「永続性」とは分類せず、「持続性」あるいは「長期持続性」に分類します。
【6】心房細動の発症因子と予防
心房細動の発症に関わる因子として、肥満、運動不足、喫煙、飲酒、高血圧、閉塞性睡眠時無呼吸症候群、心不全、糖尿病などが知られています。
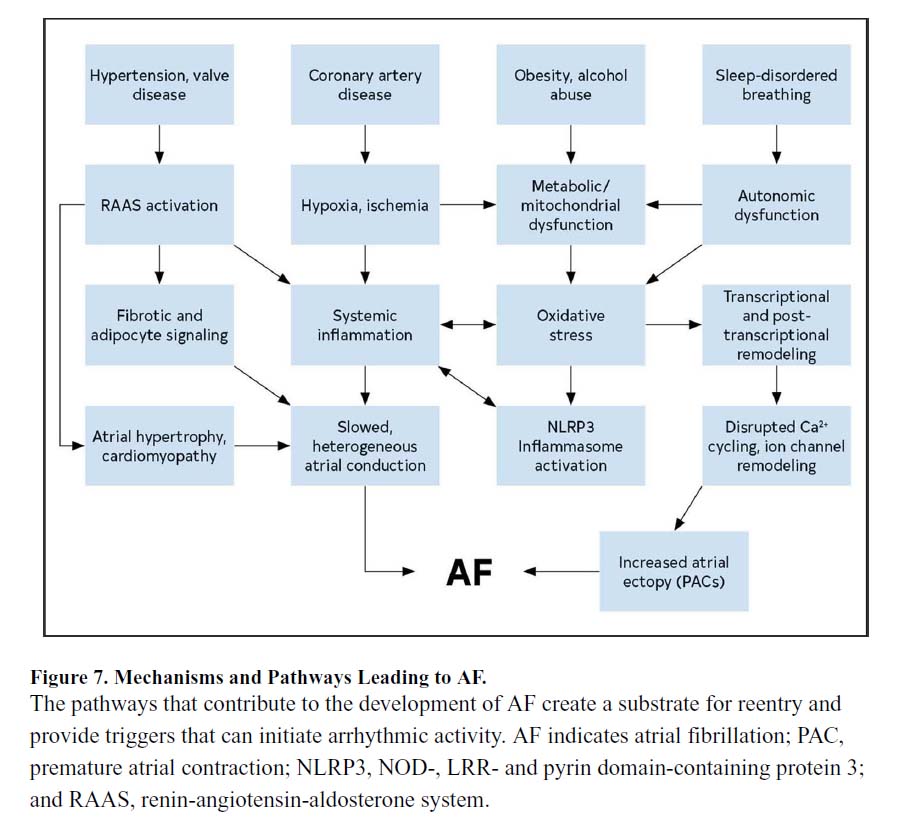 文献1】より
文献1】より
1)肥満
肥満は、心房細動の発症と進行に関連しています。脂肪細胞の増加により、心房細動の基質を形成する心房心筋に直接変化が生じます。肥満は、洞調律を維持する治療に重大な悪影響を及ぼし、BMIが5単位増加するごとに、アブレーション後の心房細動の再発リスクが13%高くなります。体重の管理は、心房細動の予防と治療において重要です。BMI >27で心房細動の肥満の人を対象とした二重盲検試験では、体重減少が不整脈症状、再発の軽減と関連していました。BMI中央値が33.6の1415人の心房細動患者を対象とした2015年のLEGACY研究では、10%以上体重が減少すると、不整脈のない生存期間が6倍に増加することがわかりました。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.太りすぎまたは肥満の心房細動患者(BMI >27)の場合、減量が推奨され、少なくとも10%の体重減少が理想的な目標です。 | 1 | B-R |
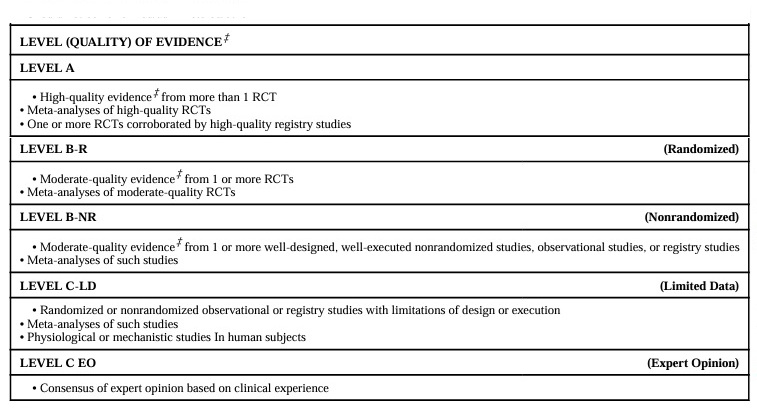
ガイドラインの推奨度とエビデンスの度合いについて
米国のガイドライン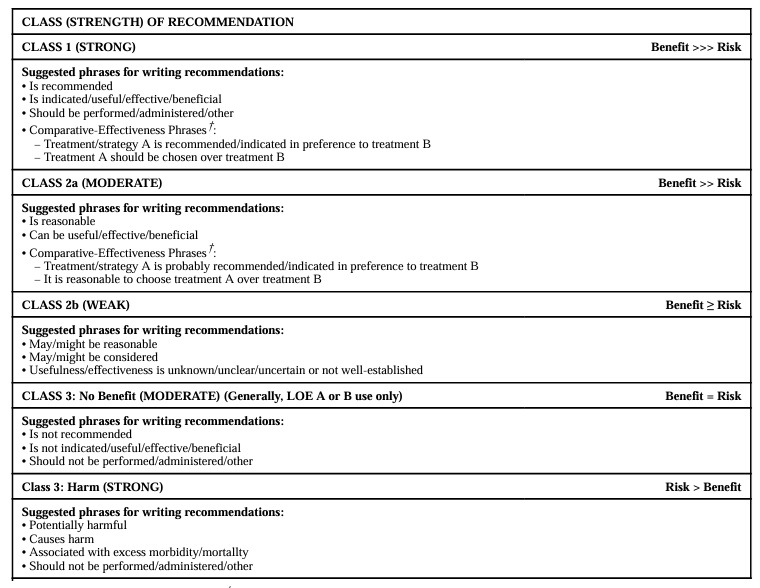
 文献1】より
文献1】より
ヨーロッパのガイドライン
 文献2】より
文献2】より
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.肥満者では、心房細動を予防するために減量を検討すべきです。 | IIa | B |
| 2.一般集団では、心房細動を予防するために正常体重(BMI 20~25 kg/m2)を維持することが推奨されます。 | I | B |
| 3.肥満の心房細動患者では、症状と心房細動の負担を軽減するために、包括的な危険因子管理の一環として減量が推奨され、体重の10%以上の減少を目標とします。 | I | B |
| 4.心房指導を有し、BMIが40 kg/m2以上の患者において、リズムコントロール戦略が計画されている場合、心房指導の再発および進行を抑制するため、生活習慣の改善および内科的管理と併せて肥満手術が考慮される場合があります。 | IIb | C |
2)運動不足
ランダム化試験では、有酸素運動が発作性心房細動と持続性心房細動の患者の両者において機能的能力と健康関連のQOLを改善する可能性があるというエビデンスが報告されています。2023年のACTIVE-AF(An Exercise and Physical Activity Program in Patients With Atrial Fibrillation)無作為化臨床試験では、発作性または持続性の症候性心房細動の患者は、中程度から激しい運動(週に210分を目標、6ヶ月間)を通常のケアに追加した場合、心房細動エピソードの減少と短縮、症状負担の軽減、心肺機能の改善を経験したことが示されました。心房細動の発症後に定期的な運動を開始または継続することは、集団ベースのコホート研究で心不全および死亡率のリスクの低下と関連していました。運動処方は、肥満、高血圧、糖尿病などの患者の併存疾患に対しても有効です。ただし、特に50歳以上の場合、心血管系への負荷が大きい過度の持久運動(マラソンや長距離トライアスロンなど)は避けるべきです。さらに、過度の運動【高強度の持久力トレーニング (>3 時間/日) 】は、特に若い男性アスリートにおける心房細動の高発生率と関連しています。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.心房細動の方には、心房細動の症状や負担の軽減、洞調律リズムの維持向上、QOLの向上のために、週210分を目標に中程度から激しい運動トレーニングを推奨します。 | 1 | B-R |
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.発作性または持続性心房細動の患者には、心肺機能を改善し、心房細動の再発を減らすため、個人に合わせた運動プログラムが推奨されます。 | I | B |
| 2.心房細動を予防するためには、活動的なライフスタイルを維持することが推奨され、これは中等度の有酸素運動を週150~300分、または高強度の有酸素運動を週75~150分行うことに相当します。 | I | B |
3)喫煙
観察データは、心房細動患者の喫煙が心血管系の転帰および死亡の悪化と関連しており、禁煙した心房細動患者が心血管病変や脳卒中を発症したり死亡したりする可能性が低いことを裏付けています。心房細動の患者では、カテーテルアブレーションを受けた後、現在の喫煙中の方は心房細動再発のリスク増加と関連していました。喫煙中の心房細動の人は、脳卒中、心不全、入院、死亡のリスクが増加したと報告されている研究が圧倒的に多いです。さらに、喫煙は抗凝固療法の有効性を低下させ、それによって脳卒中のリスクを高めます。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.タバコを吸う心房細動の病歴のある患者は、関連の心血管合併症やその他の有害な結果のリスク増加を軽減するために禁煙することを強く推奨します。 | 1 | B-R |
4)飲酒
アルコール摂取は、血栓塞栓症、死亡、心房細動関連の入院など、心房細動患者の有害事象のリスクを高める可能性があります。アルコールは、新たに心房細動と診断された患者の脳梗塞のリスク増加と関連しており、心房細動の診断後に禁酒すると、脳梗塞のリスクを減らすことができます。心房細動患者では、ある研究によると、アルコール摂取の数時間後に心房細動を起こすリスクが高いことが明らかになりました。別の報告では、禁酒または週に3杯未満の節酒は、心房細動の症状、心房細動の負担、発作性から持続性への心房細動の進行を軽減することが実証されています。抗凝固療法を受けている患者では、アルコール過剰は出血のリスクが高いことと関連しています。アルコール摂取は、カテーテルアブレーション後の心房細動の再発の用量依存的な増加と関連しています。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.リズムコントロール治療を求める心房細動の患者は、心房細動の再発と負担を減らすために、アルコール摂取を最小限に抑えるか禁酒する必要があります。 | 1 | B-R |
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.一般集団では、心房細動を予防するために、過度の飲酒を避けることが推奨されます。 | I | B |
| 2.心房細動の再発を減らすための包括的なリスク因子管理の一環として、週あたりのアルコール摂取量を3標準ドリンク以下(アルコール量30グラム以下)に減らすことが推奨されます。 | I | B |
5)高血圧
心房細動患者の高血圧は、脳卒中、心不全、大出血、心血管系死亡のリスク増加と関連しています。高血圧は心房細動症例の~20%を占めています。Framingham Heart Studyのデータでは、高血圧が15年の間に心房細動のリスクを2倍にすることを示しました。ほとんどの成人において収縮期血圧の治療目標は120-129mmHgです。拡張期血圧の治療目標は、理想的には70-79mmHgです。血圧の関する22件のランダム化試験をまとめたメタアナリシスでは、収縮期血圧の5mmHgの減少により、主要な心血管イベントのリスクが9%減少し(HR、0.91;95%CI、0.83-1.00)、心房細動または洞調律の患者でも同様の効果がありました。降圧剤に関しては、ミネラルコルチコイド受容体拮抗薬のランダム化研究は、心房細動の負担を軽減することが示されており、ACE阻害薬とアンジオテンシンII受容体拮抗薬(ARB)は、ランダム化研究の二次解析において心房細動の発生率の低下と関連していました。心房細動患者の脳卒中リスクを低減するためのDOAC臨床試験の事後解析では、血圧が制御された患者の脳卒中発生率が一貫して低いことがわかっています。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.心房細動および高血圧の患者には、心房細動の再発および心房細動関連の心血管イベントを減らすために、最適な血圧管理が推奨されます。 | 1 | B-NR |
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.高血圧症を伴う心房細動患者には、心房細動の再発および進行を減らし、有害な心血管イベントを予防するために、血圧降下療法が推奨されます。 | I | B |
| 2.一般集団では、心房細動を予防するために最適な血圧を維持し、ACE阻害薬またはARBを第一選択薬として推奨されます。 | I | B |
6)閉塞性睡眠時無呼吸症候群
閉塞性睡眠時無呼吸症候群は心房細動発症の危険因子であり、心房細動の患者に閉塞性睡眠時無呼吸症候群の睡眠ポリグラフ検査などの検査を行った場合、心房細動と診断された患者の>20%でこの疾患が観察されました。403,187人の参加者を対象としたUK Biobankの研究では、健康な睡眠パターンを持つ人は、睡眠衛生が悪い人と比較して、心房細動を発症するリスクが29%低いことが明らかになりました。複数の観察研究では、閉塞性睡眠時無呼吸症候群の治療を受けている患者と受けていない患者と比較して、心房細動の再発が少なく、心臓除細動やカテーテルアブレーション処置後など、心房細動の負担が軽減されたことが報告されています。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.心房細動の患者における閉塞性睡眠時無呼吸症候群の有病率が高いことを考えると、心房細動の患者の中で、閉塞性睡眠時無呼吸症候群をスクリーニングすることは合理的かもしれません。 | IIb | B-NR |
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.心房細動患者の再発および進行を抑制するため、閉塞性睡眠時無呼吸の管理は、心房細動患者のリスク因子の包括的管理の一環として考慮される場合があります。 | IIb | B |
| 2.心房患者の閉塞性睡眠時無呼吸のスクリーニングにおいて、症状に基づく質問票のみを使用することは推奨されなません。 | III | B |
7)心不全
心不全は、心房細動患者の予後の主要な決定要因であり、心房細動の再発と進行に関連する重要な要素です。フラミンガムコホートでの30年間の追跡期間中、新たな心不全の患者の57%が心房細動を併発し、新たな心房細動の患者の37%が心不全を発症しました。心不全の適切な管理は、例えば、有害な心房および心室心筋のリモデリングを減らすことにより、心房細動の再発を減らす可能性がありますが、特定の治療法に関するデータは限られています。
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.HFrEF(収縮機能が低下した心不全)の患者では、心房細動を予防するために適切な心不全治療が推奨されます。 | I | B |
| 2.心房細動、心不全のある患者には、症状を緩和し、心不全の管理を改善するために利尿薬の使用が推奨されます。 | I | C |
| 3.心不全を伴う心房細動患者には、症状、心不全による入院を軽減し、心房細動の再発を予防するために、心不全に対する適切な薬物療法が推奨されます。 | I | B |
| 4.心不全合併心房細動患者には、左室駆出率に関わらず、心不全による入院および心血管死のリスクを低減するために、ナトリウム・グルコース共輸送体(Sodium-glucose transporter:SGLT)2阻害薬の使用が推奨されます。 | I | A |
8)糖尿病
糖尿病は、心房細動患者の約25%に存在します。糖尿病と心房細動の両方を合併した患者は予後不良で、医療利用の増加、超過死亡、心血管イベントの増加と関連しています。さらに、糖尿病は血栓塞栓症のリスクに影響を与える主要な要因です。心房細動のカテーテルアブレーション後、糖尿病の悪化(HbA1cの増加)は、入院期間の増加と心房細動の再発の増加と関連しています。各々の血糖降下薬が心房細動に及ぼす影響は様々ですが、糖尿病合併心房細動患者におけるSGLT2およびグルカゴン様ペプチド-1拮抗薬の使用に関する新たなデータがあり、近い将来、治療選択に影響を与える可能性があります。
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.糖尿病合併心房細動患者においては、心房細動の負担、再発、進行を軽減するために、包括的なリスク因子管理の一環として、効果的な血糖コントロールが推奨されます。 | I | C |
| 2.糖尿病の薬物療法が必要な患者には、心房細動を予防するためにメトホルミンまたはSGLT2阻害薬の使用を検討すべきです。 | IIa | B |
【7】心房細動に対する治療
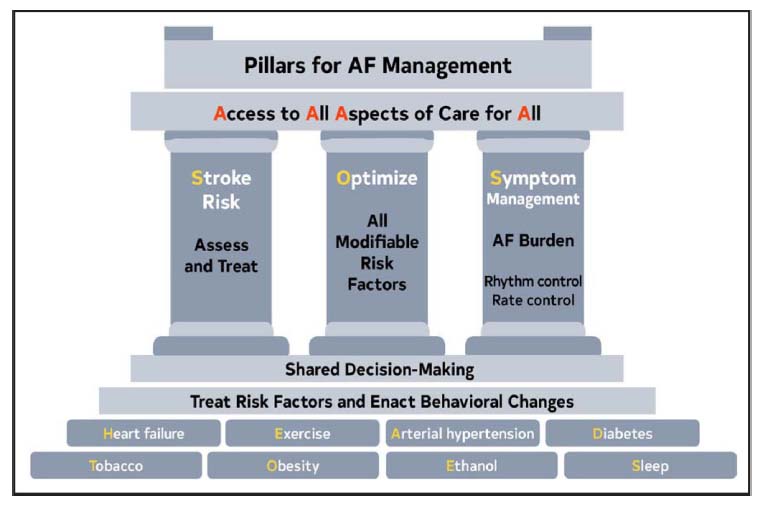
心房細動の治療方針に関わるのは患者の血行動態であり、心不全やショックを合併していれば、急性期治療がまず必要となります。実際には血行動態の安定した患者が多く、脳梗塞のリスクを評価し、適応があれば抗凝固薬、心拍数に応じてレートコントロール薬を投与します。また心房細動の症状やタイプ、持続期間などに応じて、リズムコントロール薬の投与やアブレーションなどの非薬物的治療を考慮します。米国、ヨーロッパのガイドラインにおける心房細動の管理の基本概念は以下のようになっています。米国のガイドラインでは、心房細動の提案された管理で合計3つの頭字語が使用されています。治療の基本は、心不全(H)、運動(E)、動脈性高血圧症(A)、糖尿病(D)、タバコ(T)、肥満(O)、エタノール(E)、睡眠(S)の側面を表す頭字語HEAD 2 TOESで略される併存疾患の診断と管理でもあります。心房細動の治療の3つの柱はSOS:脳卒中リスクの評価と治療(S)、すべての修正可能なリスク要因の最適化(O)、および速度とリズムのコントロール(S)です。心房細動の治療の包括的な原則は、4A(Access to All Aspects of Care for All)となります。注目すべきは、AF-CARE(ヨーロッパ)とHEAD 2 TOES(米国)の両方が、併存疾患と危険因子の診断と治療において重要な位置を占めていることです。どちらのガイドラインも、心房細動は孤立した心電図現象ではなく、特定の併存疾患のコンテキストで発生するか、特定のリスク プロファイルに関連していることを強調しています。素因となる併存疾患や危険因子の早期治療は、確かに特に関連性があり、孤立した心房細動療法よりも持続的に再発や有害事象を回避することができます。
米国のガイドライン
S Stroke Risk 脳梗塞などの血栓塞栓症の予防
O Optimaize 増悪因子の管理
S Symptom management 症状の管理(レートコントロール、リズムコントロール)
 文献1】より
文献1】より
ヨーロッパのガイドラインでは、心房細動の管理として、AF-CAREを導入し、併存疾患の側面(C)を初めて前面に位置付け、続いて脳卒中と血栓塞栓症の回避(A)、速度とリズムのコントロール(R)、および個別の評価とフォローアップ(E)を位置付けました。
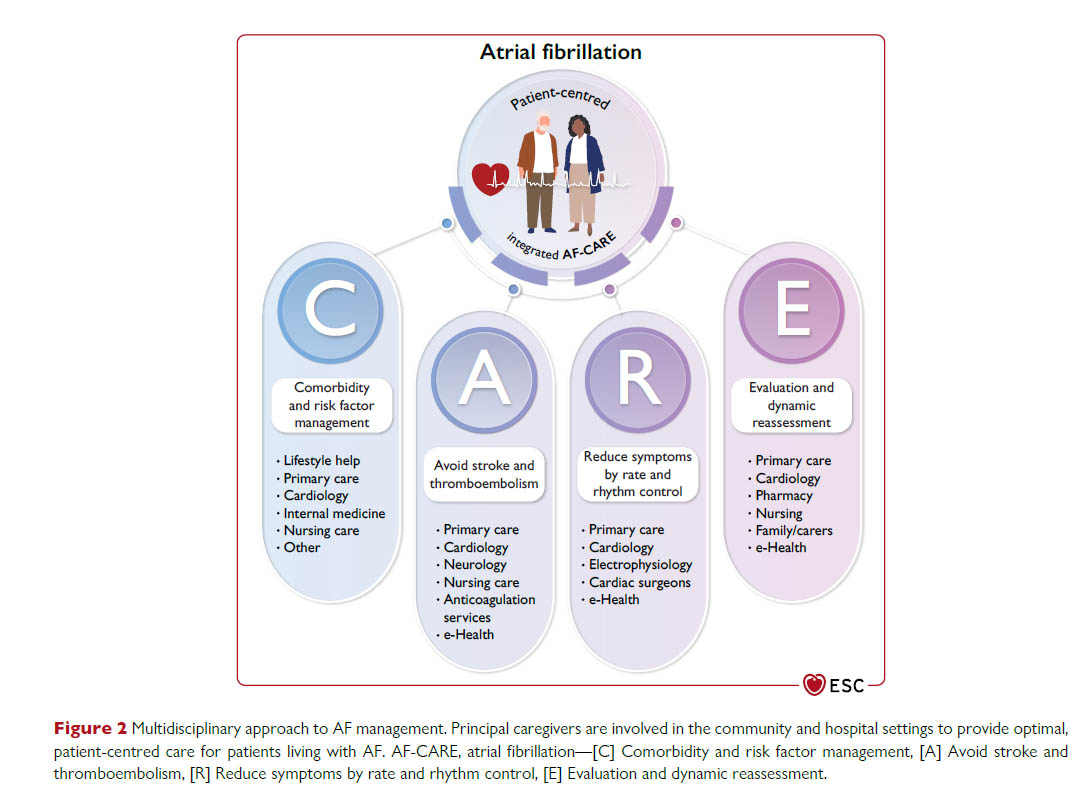 文献2】より
文献2】より
AF-CAREの原則
患者、家族、介護者、医療従事者への教育は、共同意思決定を最適化し、各治療選択肢に関連するベネフィットとリスクの両方についてオープンな議論を促進するために推奨されます。
AF-CAREの原則に従った患者中心の管理へのアクセスは、性別、民族、社会経済的地位にかかわらず、すべてのAF患者に推奨されます。これは、医療提供の平等を確保し、転帰を改善するためです。
心房細動のすべての患者において、管理を最適化し、転帰を改善するために、多職種アプローチによる患者中心の心房細動管理を検討する必要があります。
C Comorbidity and risk factor management 合併症、危険因子の管理
A Avoid stroke and thromboembolism 脳梗塞などの血栓塞栓症の予防
R Reduce symptoms by rate and rhythm control 速度とリズムのコントロールによる症状の管理
E Evaluation and dynamic reassessment 個別の評価とフォローアップ
1)血栓塞栓症の予防
脳卒中の予防は、心房細動患者にとって、生存率、健康、QOLを最大化するために重要です。脳卒中リスク低減療法の選択は、患者の脳卒中リスク、治療による出血のリスク、個々の好みによって導かれるべきです。心房細動患者の脳卒中リスクを評価するために、いくつかの臨床リスクスコアが開発されています。2001年に導入された CHADS2スコアには、うっ血性心不全、高血圧、年齢、糖尿病、脳卒中または一過性脳虚血発作の病歴がスコアに含まれます。2010年に開発された CHA2DS2-VAScスコアは、血管疾患、女性の性別、年齢区分などの追加の危険因子を組み込むことにより、血栓塞栓症の予測を改善しました。CHA2DS2-VAScスコアが2の患者の年間脳卒中リスクは、1%~2%の範囲になるという研究結果があります。最近、CHA2DS2-VAScスコアにおける性成分の役割が再評価されました。以前の研究では、心房細動の女性は男性に比べて虚血性脳卒中のリスクが有意に高く、経口抗凝固療法を受ける可能性が低く、その結果、女性の脳卒中転帰がより深刻になることがわかりました。しかし、心房細動の管理に関する2024年のヨーロッパのガイドラインでは、CHA2DS2-VAScスコアから女性の性別が除外されており、これは独立したリスク要因ではなく、年齢依存の脳卒中リスク修飾因子として機能すると述べています。抗凝固療法が適応となる場合、中等度から重度の僧帽弁狭窄症、機械的心臓弁置換術後、特定の血栓症 (抗リン脂質症候群など) の患者を除き、ワルファリンよりも直接経口抗凝固薬 (DOAC) が推奨されます。消化器系、呼吸器系、泌尿器系、頭蓋内/脊髄内のコントロール困難な出血を有する患者では、長期抗凝固療法は禁忌です。経口抗凝固薬に耐えられない心房細動患者の場合、脳卒中予防のための経口抗凝固薬の代替として左心耳閉塞術が考慮します。しかし、アスピリンなどの抗血小板薬は、米国、ヨーロッパの両ガイドラインにおいて、心房細動の脳卒中予防には適さないと記されています。

| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.CHA2DS2-VAScなどのスコアを用いて、心房細動の患者は、血栓塞栓症イベントの年間リスクについて評価する必要があります。 | 1 | B-NR |
| 2.心房細動の患者は、出血のリスクが高いことを具体的に示す要因(以前の出血イベント、出血のリスクを高める薬の使用の有無など)について評価されるべきです。 | 1 | B-NR |
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.適切な患者に抗凝固療法が開始されるように、心房細動患者では定期的に血栓塞栓症リスクを個別に再評価することが推奨されます。 | I | B |
| 2.血栓塞栓症リスクが高い臨床的心房細動患者には、虚血性脳卒中および血栓塞栓症を予防するために、経口抗凝固薬の投与が推奨されます。 | I | A |
| 3.心房細動患者において、虚血性脳卒中または血栓塞栓症の予防を目的として、抗凝固療法の代替療法として抗血小板療法を行うことは推奨されません。 | III | A |
| 4.心房細動患者において、虚血性脳卒中または血栓塞栓症の予防を目的として、経口抗凝固薬に抗血小板薬を追加することは推奨されません。 | III | B |
| 5..臨床的な心房細動の経過パターン(発作性、持続性、永続性)に基づいて経口抗凝固療法の必要性を判断することは推奨されません。 | III | B |
a. ビタミンK拮抗薬
1950年代以降、ビタミンK拮抗薬であるワルファリンはDOAC(direct oral anticoagulant:直接経口抗凝固薬)が実用化されるまで、第一選択療法として使用されていました。頻繁に採血(PT-INR:プロトロンビン時間の国際正規化比)によるモニタリングが必要な事、数多くの薬物相互作用(主にCYP2C9による)があること、納豆などの食事制限が必要なこと、低い臨床的安全性プロファイルなどがあるために、日常的にワルファリンを使用することが少なくなってきました。一部の心房細動患者にとってはDOACが高額であるという問題があるため、ワルファリンは依然として適切な抗凝固剤です。非弁膜症性心房細動患者の約21%は依然としてワルファリンを投与されております。ワルファリンは、中等度から重度のリウマチ性僧帽弁狭窄症または機械的心臓弁置換術後の心房細動を有する患者における第一選択治療として残っています。目標のPT-INRは2-3であり、INRが4を超えると出血のリスクがほぼ明らかになることが示されています。
b. 直接経口抗凝固薬(DOAC:direct oral anticoagulant)
DOACはワルファリンの欠点に対処するために開発され、現在、米国、ヨーロッパ、日本のガイドラインでは心房細動患者(中等度から重度の僧帽弁狭窄症または機械的心臓弁を入れた患者を除く)に対する抗凝固療法の第一選択療法として推奨されています。個々のDOAC(アピキサバン【商品名 エリキュース 2.5mg, 5mg】、ダビガトラン【商品名 プラザキサ 75mg, 110mg】、エドキサバン【商品名 リクシアナ 15mg, 30mg, 60mg】、リバロキサバン【商品名 イグザレルト 10mg, 15mg】)とワルファリンを比較した4つの重要な臨床試験はすべて、中等度から重度の僧帽弁狭窄症または機械的心臓弁置換術後の患者を除く心房細動患者の脳卒中または全身性塞栓症の予防において、ワルファリンに対する優越性または非劣性を示しました。また、アピキサバン、ダビガトラン110mgを1日2回投与群、エドキサバン30mgまたは60mgを1日投与した群では、ワルファリン投与群と比較して大出血のリスクが有意に低かったこと、またはダビガトラン150mgを1日2回投与群またはリバロキサバン投与群とワルファリンとの間に大出血の有意差が認められなかったことが示されました。すべてのDOACグループは、ワルファリンと比較して頭蓋内出血のリスクが有意に低いことを示しました。消化管出血リスクは、ワルファリン群と比較して、ダビガトラン150mgを1日2回、エドキサバン60mgを1日1回、リバロキサバン群で有意に高かったと報告されています。しかし、アピキサバン群はワルファリン群と比較して消化管出血のリスクを有意に増加させませんでした。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.心房細動で推定年間血栓塞栓症のリスクが年間>2%の患者の場合(CHA2DS2-VASc 男性で>2、女性で>3)、脳卒中および全身性血栓塞栓症を予防するために抗凝固療法が推奨されます。 | 1 | A |
| 2.中等度から重度のリウマチ性僧帽弁狭窄症または機械的心臓弁手術の病歴がなく、抗凝固療法の候補である心房細動患者では、死亡、脳卒中、全身性塞栓症、頭蓋内出血のリスクを減らすために、ワルファリンよりもDOACが推奨されます。出血リスクを単純に出血スコアだけで判断するのではなく、総合的に出血リスクを検討した後に抗凝固療法を開始します。 | 1 | A |
| 3.心房細動で推定年間血栓塞栓症のリスクが年間1-2%の患者の場合(CHA2DS2-VASc 男性で1、女性で2)、抗凝固療法は 脳卒中および全身性血栓塞栓症を予防するために合理的です。抗凝固療法を使用するか否かについては、抗凝固剤の利点、脳卒中のリスクについて、患者と相談し決定します。 | 2a | A |
| 4.抗凝固療法の候補であり、抗血小板療法の適応がない心房細動患者では、アスピリン単独またはクロピドグレルと組み合わせて 抗凝固療法の代替として、脳卒中のリスクを減らすことは推奨されません。 | 3: Harm | B-R |
| 5.脳卒中の危険因子のない心房細動患者では、血栓塞栓症の予防のためのアスピリン単剤療法は有益ではありません。 | 3: No Benefit | B-NR |
| 6.DOACを受けている心房細動患者の場合、薬物相互作用の最適な管理が推奨されます。相互作用する薬物としては、CYP3A4やp-糖タンパク質阻害剤などが上げられます。(表13)。 | 1 | C-LD |
| 7.ワルファリンを投与されている心房細動患者には、予防可能な血栓塞栓症や大出血のリスクを最小限に抑えるために、薬物間相互作用の最適な管理、ビタミンK含有の食事摂取制限、定期的なINRモニタリング(目標INR 2-3)が推奨されます。 | 1 | B-R |
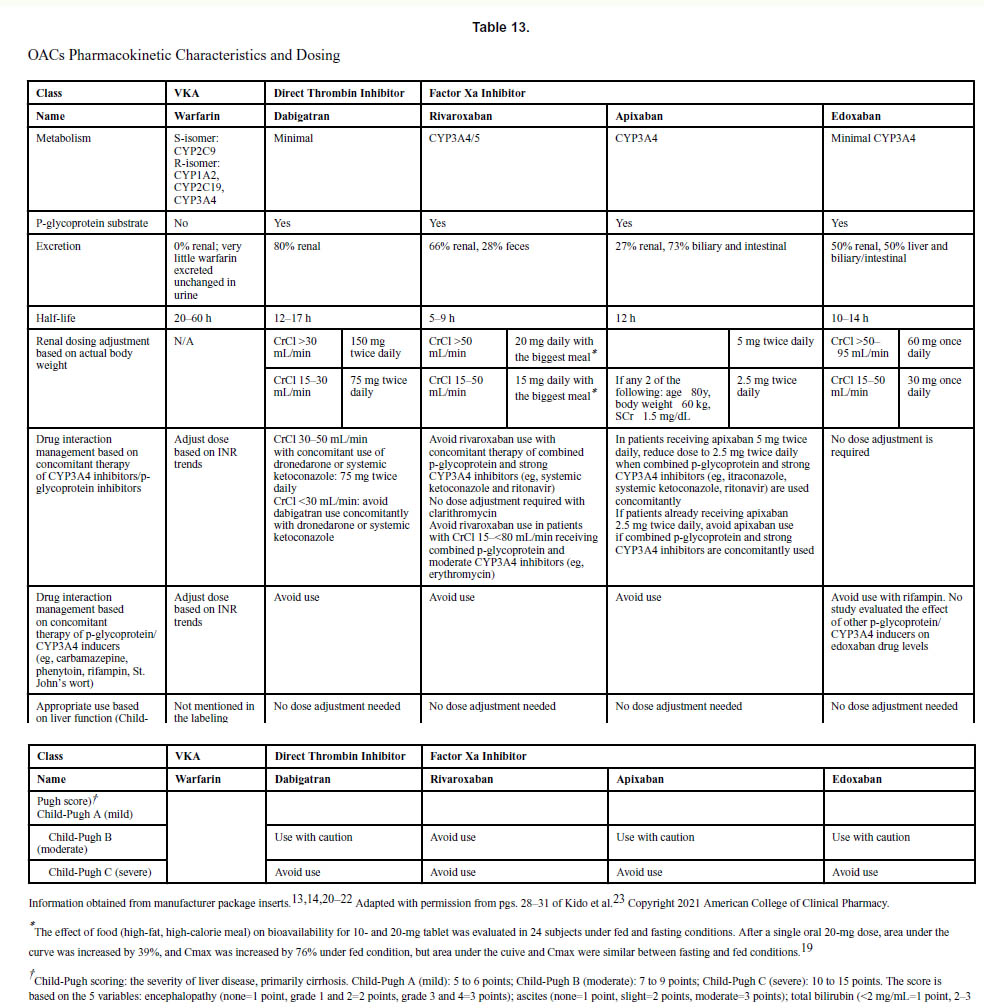 . 文献1】より
. 文献1】より
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.CHA2DS2-VAスコアが2以上であることは、経口抗凝固薬の開始を決定する上で、血栓塞栓症リスクが高いことを示す指標として推奨されます。 | I | C |
| 2.CHA2DS2-VAスコア 1は、経口抗凝固療法の開始を決定する上で、血栓塞栓症リスク上昇の指標とみなすべきです。 | IIa | C |
| 3.虚血性脳卒中および血栓塞栓症を予防するため、CHA2DS2-VAスコアに関わらず、心房細動を合併した肥大型心筋症または心アミロイドーシスを有するすべての患者に経口抗凝固療法が推奨されます。 | I | B |
| 4.DOACの減量は、腎機能低下などのDOAC特有の基準を満たさない限り、推奨されません。 | III | B |
| 5.75歳以上の患者で、臨床的に安定したワルファリンを服用している患者は、過剰な出血リスクを予防するために、DOACへの切り替えではなくワルファリン治療の継続が考慮される場合があります。 | IIb | B |
| 6.機械的心臓弁手術後または中等度から重度の僧帽弁狭窄症の患者を除き、虚血性脳卒中および血栓塞栓症の予防には、ワルファリンよりもDOACが推奨されます。 | I | A |
| 7.脳卒中予防のためにワルファリンを処方されたAF患者の場合、安全性と有効性を確保するために、目標INRを2.0~3.0とすることが推奨されます。 | I | A |
| 8.ワルファリンで十分な治療時間(TTR < 70%)を維持できなかった患者には、血栓塞栓症および頭蓋内出血を予防するためにDOACへの切り替えが推奨されます。 | I | A |
| 9.心房細動患者において、塞栓性脳卒中の再発を予防するために、明確な適応がないままDOACから別のDOAC、またはDOACからワルファリンに切り替えることは推奨されません。 | III | B |
c. 抗凝固療法中の活動性出血に対する対応
抗凝固療法を受けた患者の約2%~4%が大出血を経験し、介入を必要とします。活性炭は、抗凝固薬の最終投与後6~8時間まで投与できます。DOAC投与中の出血による救急外来受診の割合は、過去10年間でDOACの使用が増加したため、2011年の2.3%から2017年には37.9%に増加しました。効果的な止血を達成できないと、死亡リスクが3倍以上高くなります。ダビガトラン誘発性大出血に対するイダルシズマブ【商品名 プリズバインド】と、アピキサバンまたはリバロキサバン関連大出血に対するアンデキサネット アルファ【商品名 オンデキサ】は、米国食品医薬品局(FDA)の承認を受けています。ワルファリンの場合、生命を脅かす出血を支持療法で管理できない場合は、新鮮な凍結血漿よりも活性化プロトロンビン複合体濃縮物による迅速な逆転治療が好まれます。表 15 は、OAC の反転エージェントをまとめたものです。表16は、重要な臨床試験におけるDOACに起因する出血イベントを示しています。
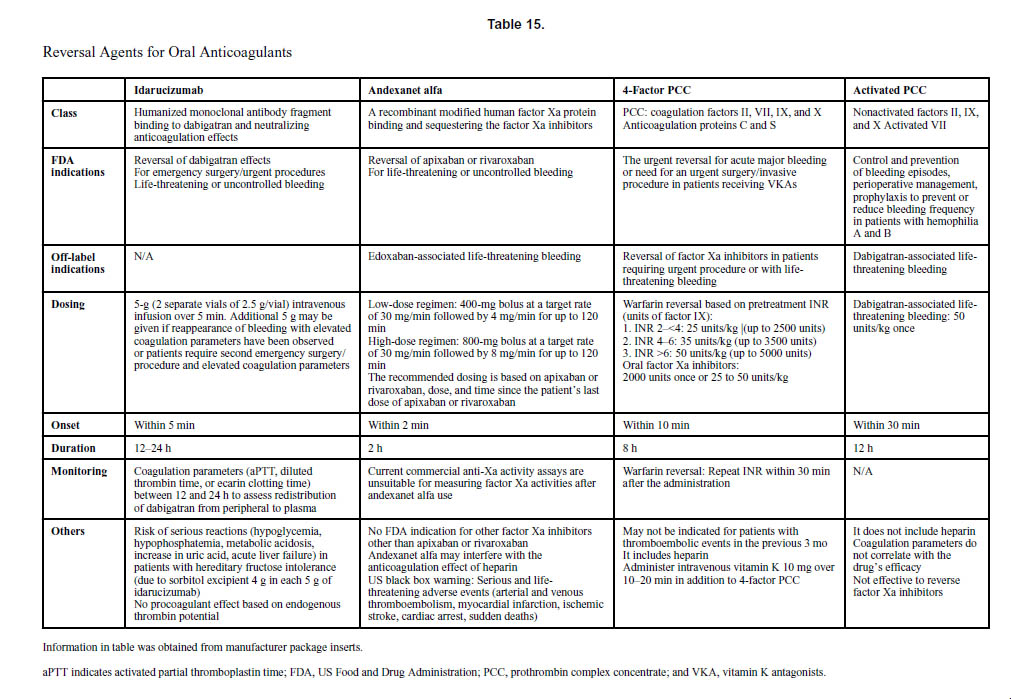 文献1】より
文献1】より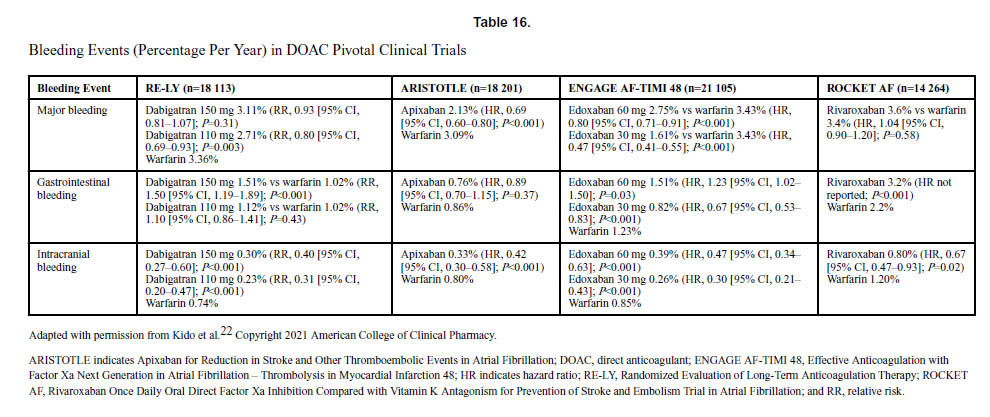 文献1】より
文献1】より
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.ダビガトランを投与されている心房細動患者で生命を脅かす出血を発症した場合、ダビガトランの抗凝固作用を迅速に回復させるために、イダルシズマブ【商品名 プリズバインド】による治療が推奨されます。 | 1 | B-NR |
| 2.ダビガトランを投与されている心房細動患者で生命を脅かす出血を発症し、イダルシズマブが利用できない場合、活性化プロトロンビン複合体濃縮物【商品名 ケイセントラ】による治療は、ダビガトランの抗凝固効果を逆転させるのに合理的です。 | 2a | C-LD |
| 3.第Xa因子阻害剤(アピキサバン、リバロキサバン#、エドキサバン*)を投与されている心房細動患者で生命を脅かす出血を発症した場合には、アンデキサネットアルファ【商品名 オンデキサ】または活性化プロトロンビン複合体濃縮物【商品名 ケイセントラ】*のいずれかによる治療が推奨されます。 | 1 | B-NR#, C-LD* |
| 4.生命を脅かす出血を発症したワルファリンを投与されている心房細動患者では、静脈内ビタミンKに加えて、活性化プロトロンビン複合体濃縮物【商品名 ケイセントラ】による治療が推奨されます。 | 1 | A |
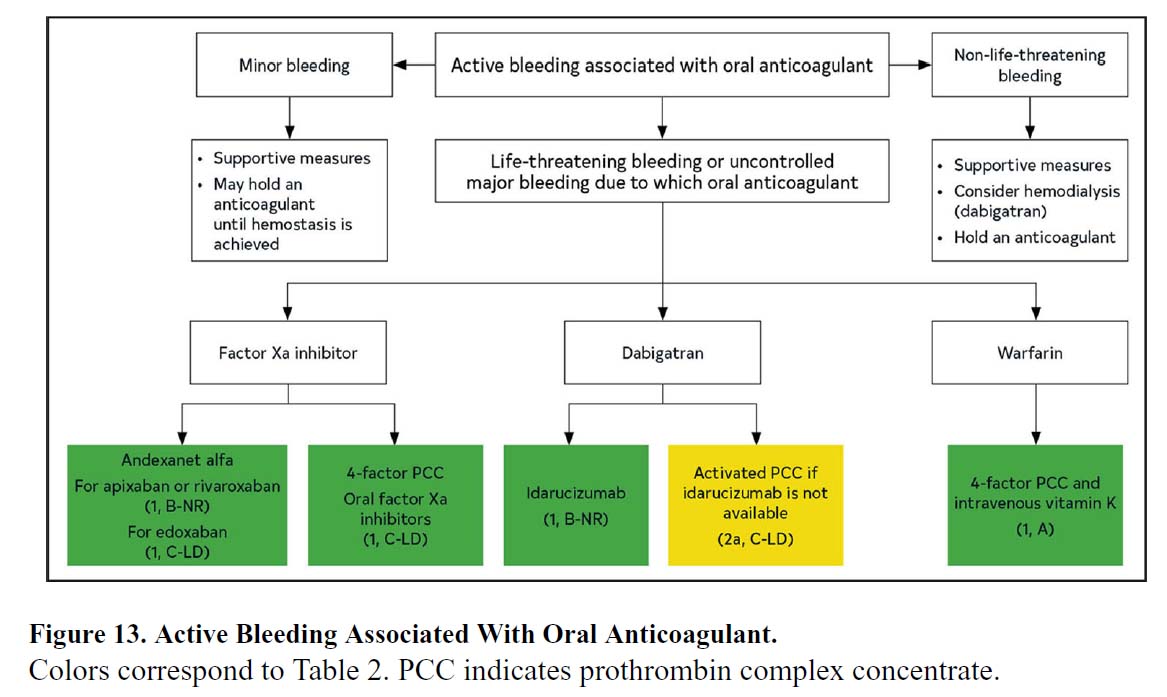 文献1】より
文献1】より
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.経口抗凝固療法の対象となるすべての患者において、安全性を確保し、出血を予防するための共同意思決定の一環として、修正可能な出血リスク因子の評価と管理が推奨されます。 | I | B |
| 2.心房細動患者において、抗凝固療法の過少使用を避けるため、経口抗凝固療法の開始または中止を決定する際に出血リスクスコアを使用することは推奨されません。 | III | B |
| 3.DOACを服用中の心房細動患者において、生命を脅かす出血または重要部位への出血が認められた場合、抗血栓作用を打ち消すために特異的な解毒剤の使用を考慮するべきです。 | IIa | B |
| 4.活動性出血のある心房細動患者では、出血の原因が特定され解決されるまで、抗凝固療法を中断し、診断または治療介入を行うことが推奨されます。 | I | C |
d. 周術期管理
周術期抗凝固療法の管理は、2つの相反する項目を考慮しなければなりません。抗凝固剤を可能な限り短い時間だけ休薬して血栓塞栓症のリスクを最小限に抑えながら、手術中および術後の出血を最小限に抑える必要があります。侵襲的な処置と手術は、いくつかの異なる分類で高出血リスクと低出血リスクに分けられます。一般に、内視鏡、抜歯、多くの眼科的処置、心臓カテーテル法などの経皮的血管アクセスは、出血リスクが低いと考えられています。出血リスクの高い手術には、腹腔内手術、骨盤内手術、整形外科手術、神経外科手術、心臓手術などが含まれます。出血リスクが非常に高い処置や手術には、脊髄幹麻酔と脊椎手術が含まれます。患者固有の要因には、肝臓および腎臓の機能異常、出血または凝固障害、抗血小板薬または非ステロイド性抗炎症薬の併用、アルコール、貧血が含まれます。最近の出血または血栓塞栓症は、再発性イベントのリスクを高める可能性があります。血栓性リスクを大局的に見ると、抗凝固療法が一時的に中止されている間の血栓塞栓症の発生率は一般的に<1%でした。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1. 心房細動の患者(最近の脳卒中、一過性脳虚血発作、機械的弁置換術後の患者を除く)がワルファリン#またはDOAC*のいずれかによる経口抗凝固療法を受けていて、侵襲的な処置または手術を受ける予定の場合、抗凝固療法をブリッジせずに経口抗凝固療法を一時的に中止することをお勧めします。 | 1 | B-R# B-NR* |
| 2.ワルファリン抗凝固療法を受けている心房細動患者で、年間血栓塞栓症の予測リスクが5%で、ペースメーカーや除細動器の埋め込みまたは電池の交換を受ける場合、継続的な抗凝固療法が推奨されます。 ワルファリンの中断とヘパリンによる抗凝固療法のブリッジを優先して、ポケット血腫のリスクを減らします。 | 1 | A |
| 3.CHA2DS2-VASc 2の心房細動の患者では、DOAC抗凝固療法を受け、ペースメーカーや除細動器の埋め込みまたは電池の交換を受ける場合、中断するか否かについては状況によって判断するのが合理的です。 | 2a | A |
| 4.心房細動にてDOAC内服中で、侵襲的な処置または手術を受ける予定の患者では、DOACを中断すべきか否か、あるいはDOACの中断のタイミングは、特定の薬剤、腎機能、出血リスクによって導かれるべきです。 手順(表18)。 | 1 | B-NR |
| 5.心房細動患者が侵襲的な処置または手術のためにDOACを中断された場合、一般に、抗凝固療法の再開は、低出血リスク手術時には翌日に、高出血リスク手術時には2日目の夕方から3日目の夕方までの間に再開すべきです。再開前に止血が達成され、さらなる出血が予想されない事を確認します。 | 2a | B-NR |
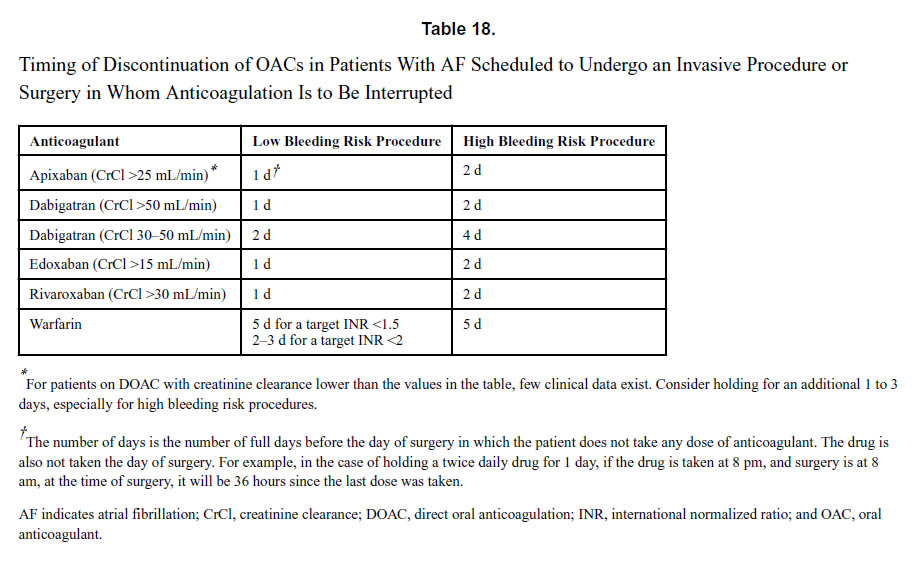 . 文献1】より
. 文献1】より
e. 経皮的左心耳閉塞術
多くの証拠が、心房細動患者の虚血性脳卒中のリスクを減らすための経口抗凝固薬の使用を支持しています。ただし、経口抗凝固薬は一部の患者では禁忌である場合があります。経皮的左心耳閉塞術は、左心耳血栓の塞栓形成を防ぎ、脳卒中のリスクを軽減するための代替療法となります。PROTECT AFおよびPREVAIL試験、PRAGUE-17試験、OPTION試験などの二重盲検試験では、経皮的左心耳閉塞術が脳卒中および全身性塞栓症に対してワルファリンおよびDOACよりも劣らず、大出血のリスクが低いことが実証されています。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.脳卒中の中等度から高いリスク(CHA2DS 2-VASc >2)があるが長期経口抗凝固療法が禁忌の心房細動の患者では、経皮的左心耳閉塞術は合理的です。 | 2a | B-NR |
| 2.脳卒中の中等度から高いリスクを有し、大出血のリスクも高い心房細動の患者では、 経皮的左心耳閉塞術が、経口抗凝固療法の合理的な代替手段となる可能性があります。 | 2b | B-R |
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.長期抗凝固療法が禁忌である心房細動患者においては、虚血性脳卒中および血栓塞栓症の予防のため、経皮的左心耳閉塞術を考慮することができます。 | IIb | C |
| 2.カテーテルまたはハイブリッドアブレーションを受ける心房細動患者においては、虚血性脳卒中および血栓塞栓症の予防のため、経口抗凝固療法の補助として経皮的左心耳閉塞術を考慮するべきです。 | IIa | C |
| 3.心房細動患者が心臓手術を受ける場合、虚血性脳卒中および血栓塞栓症を予防するため、経口抗凝固療法の補助として左心耳の外科的閉鎖が推奨されます。 | I | B |
2)レートコントロール 対 リズムコントロール
心房細動の管理には、通常、レートコントロール戦略(脈の不整はそのままにして心拍数を抑える治療)またはリズムコントロール戦略のいずれかが含まれます。リズムコントロール戦略は、除細動、抗不整脈薬、またはカテーテルアブレーション手順を通じて洞調律を回復および維持することを目的としています。レートコントロールとリズムコントロール戦略は、多くの心房細動患者で同等の臨床転帰を示しています。AFFIRM(Atrial Fibrillation Follow-up Investigation of Rhythm Management)研究では、レートコントロールは除細動薬および抗不整脈薬を用いたリズムコントロールと同等でした(HR、1.15 [95%CI、0.99-1.34];P=0.08)。 HOT CAFE (How to Treat Chronic Atrial Fibrillation) 試験では、全死因死亡率、血栓塞栓性イベント数、または大出血の複合エンドポイントに関して、レートコントロールは除細動および抗不整脈薬の使用と同等でした (OR、1.98 [95% CI、0.28-22.3];P>0.71)。 レートコントロールとリズムコントロールを比較したランダム化試験および観察研究のメタアナリシスでは、全死因死亡率(OR、1.34[95%CI、0.89-2.02])、心関連死亡率(OR、0.96[95%CI、0.77-1.20])、脳卒中(OR、0.99[95%CI、0.76-1.30])に関して、有効性は同等でした。より最近の研究では、心不全患者、症候性心不全または最近発症した心房細動患者(1年以内)、若年患者、併存疾患が少ない患者など、特定の患者集団に対してリズムコントロールがより大きな利点を提供する可能性があることが実証されています。レートコントロールを選択するか、リズムコントロールを選択するかについては、医療提供者は患者と協力して、治療戦略を決定する必要があります。
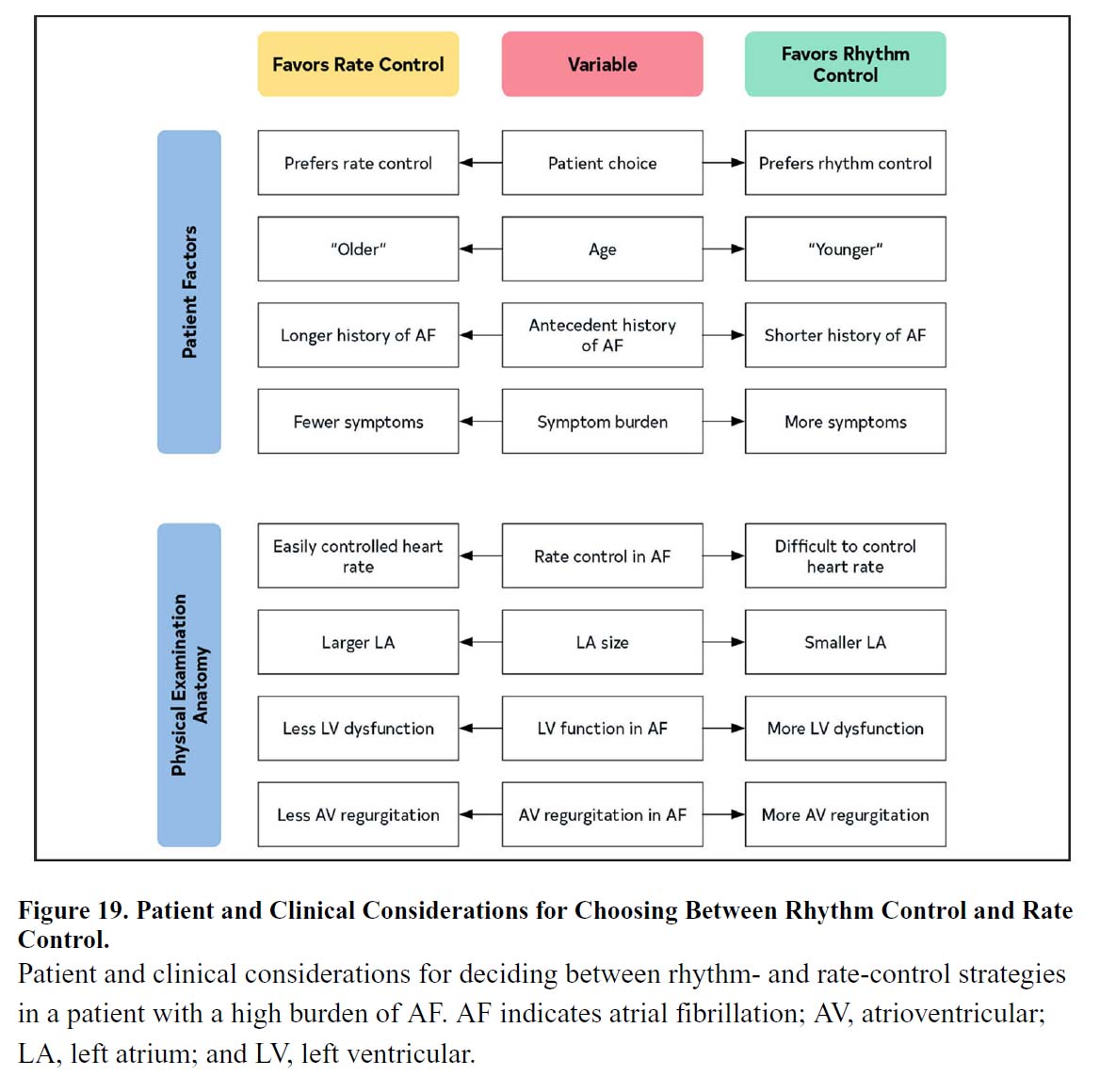 文献1】より
文献1】より
3)レートコントロール
レートコントロールの目安となる心房細動患者の最適な心拍数が単独のランダム化試験で評価されました。RACE II研究(Rate Control Efficacy in Permanent Atrial Fibrillation: A Comparison Between Lenient Versus Strict Rate Control II)では、永久心房細動の614人の患者が、寛大なレート制御(安静時心拍数 <110 bpm)または厳格なレート制御(安静時心拍数 <80 bpm)のいずれかにランダムに割り当てられました。心血管系の原因による死亡、心不全による入院、脳卒中、全身性塞栓症、出血、生命を脅かす不整脈事象の主要な複合アウトカムのいずれについても差は認められませんでした。しかし、厳密なコントロールに割り当てられた患者のうち目標のレートコントロールを達成しなかった患者の割合(32.6%;n=98/301)と、寛大なレートコントロール参加者の78%が心拍数が100bpmであることより、両グループ間の差はわずか10bpmであることによって、解釈は制限されています。さらに、心不全の患者が過小評価されていたため、この結果を心不全の患者に適応できるかどうかは不明です。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.心房細動の患者は、医療者と十分に話し合い、リズムコントロールにするか、レートコントロールにするかについて選択する必要があります。 | 1 | B-NR |
| 2.レートコントロール治療の候補である心不全のない心房細動患者では、患者の症状に注意しながら、心拍数の目標は、一般的に安静時心拍数を<100-110bpmを目指します。 | 2a | B-R |
a. レートコントロールで使用される薬剤
心房細動患者におけるレートコントロールの目標は、症状の制御と左室収縮機能障害をできるだけ起こさないようにすることに焦点を当てています。一般に、非ジヒドロピリジン系カルシウムチャネル遮断薬(ジルチアゼム、ベラパミル)およびベータ遮断薬は、心房細動のレートコントロールにおける標準治療薬です。ジルチアゼムやベラパミルは、房室結節を介した伝導を遅くし、負の変力作用および経時作用を有し、ベータ遮断薬と比較して心房細動関連の症状も改善しますが、左心室機能障害のある患者では投与を避けるべきです。ベータ遮断薬は、房室結節を介した伝導を遅らせます。ジゴキシンは、その正の変力作用と迷走神経作用により、特にHFrEF(収縮機能が低下した心不全)患者の中で、心房細動患者にとって由緒ある薬です。特定の薬剤の選択は、患者固有の特性と反応を考慮する必要があります。
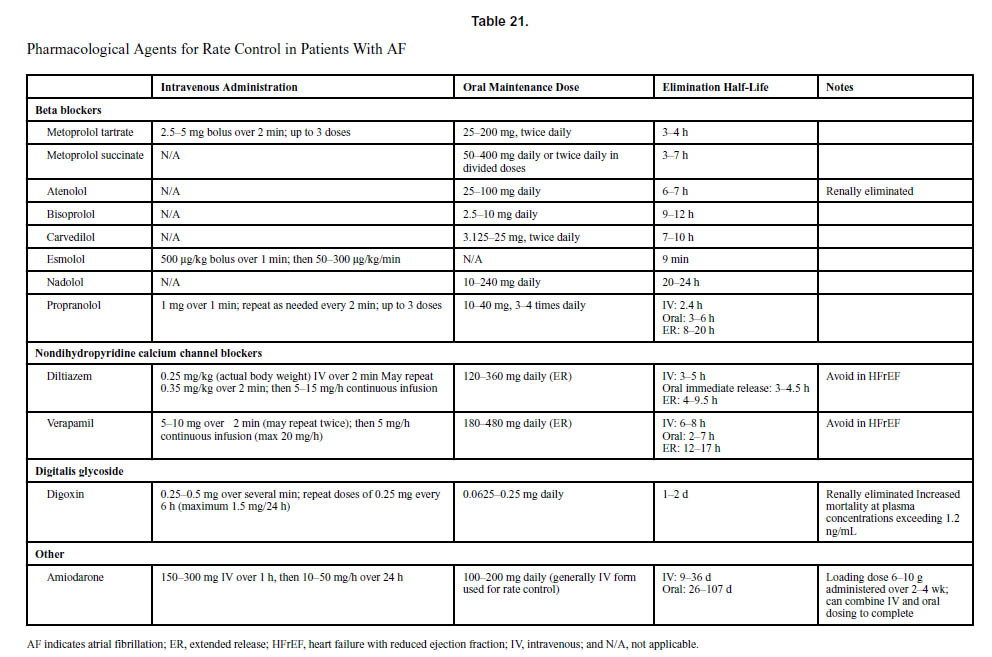 文献1】より
文献1】より
b. 急性期のレートコントロール
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.血行動態が安定している急性発症の心房細動患者では、急性期のレートコントロールとして、ベータ遮断薬または非ジヒドロピリジン系カルシウムチャネル遮断薬(ベラパミル、ジルチアゼム;ただし、EF>40%)が推奨されます。 | 1 | B-R |
| 2.ベータ遮断薬と非ジヒドロピリジン系カルシウムチャネル遮断薬は無効か禁忌であり急性発症の心房細動患者では 、ジゴキシンは、単独または前述の薬剤と組み合わせて、急性期のレートコントロールのために検討できます。 | 2a | B-R |
| 3.急性発症の心房細動患者では 、マグネシウムを静脈内投与を追加することは、レートコントロールを達成および維持するために合理的です。 | 2a | A |
| 4.重篤な疾患や非代償性心不全の心房細動の患者で、 ベータ遮断薬および非ジヒドロピリジン系カルシウムチャネル遮断薬が無効または禁忌の場合、静脈内アミオダロンは急性期のレートコントロールのために考慮される場合があります。 | 2b | B-NR |
| 5.既存の中等度または重度の左室収縮期機能障害のある急性発症の心房細動患者では、非ジヒドロピリジン系カルシウムチャネル遮断薬は静脈内投与しないでください。 | 3:Harm | B-NR |
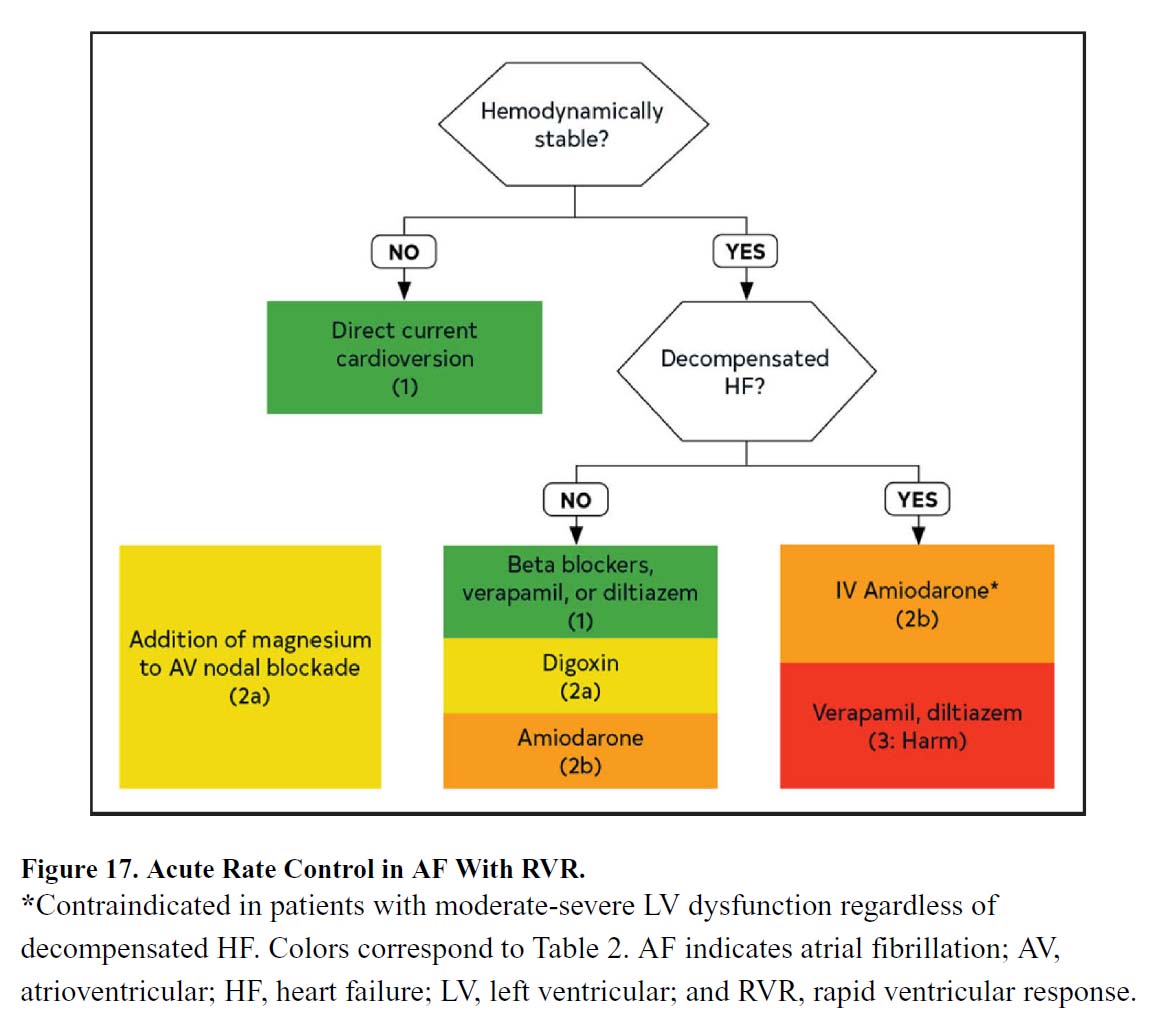 文献1】より
文献1】より
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.心房細動患者では、急性期の初期治療としてリズムコントロール療法の補助療法、または心拍数をコントロールし症状を軽減するための単独治療戦略として、レートコントロール療法が推奨されます | I | B |
| 2.心房細動で心収縮率がある程度保たれた(LVEF >40%)患者では、心拍数をコントロールし症状を軽減するために、β遮断薬、ジルチアゼム、ベラパミル、ジゴキシンが第一選択薬として推奨されます。 | I | B |
| 3.心房細動を合併した左室駆出率(LVEF)が40%以下の心不全患者では、心拍数をコントロールし症状を軽減するために、β遮断薬またはジゴキシンが推奨されます。 | I | B |
c. 長期レートコントロール
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.長期レートコントロールを必要とする心房細動の患者では、基礎疾患を考慮に入れつつ、ベータ遮断薬または非ジヒドロピリジン系カルシウムチャネル遮断薬(ジルチアゼム、ベラパミル)が推奨されます。 | 1 | B-NR |
| 2.血清ジゴキシン濃度の測定が適応となる心房細動患者の場合、<1.2 ng/mL を目標とするのが妥当です。 | 2a | B-NR |
| 3.心不全を合併した心房細動患者では、他の薬剤が無効もしくは禁忌の場合、ジゴキシンを長期レートコントロール目的で、単剤もしくは他剤と併用して使用することは合理的です。 | 2a | B-R |
| 4.LVEF <40%の心機能低下が低下した心房細動患者では、非ジヒドロピリジン系カルシウムチャネル遮断薬を、投与すべきではありません。 | 3:Harm | C-LD |
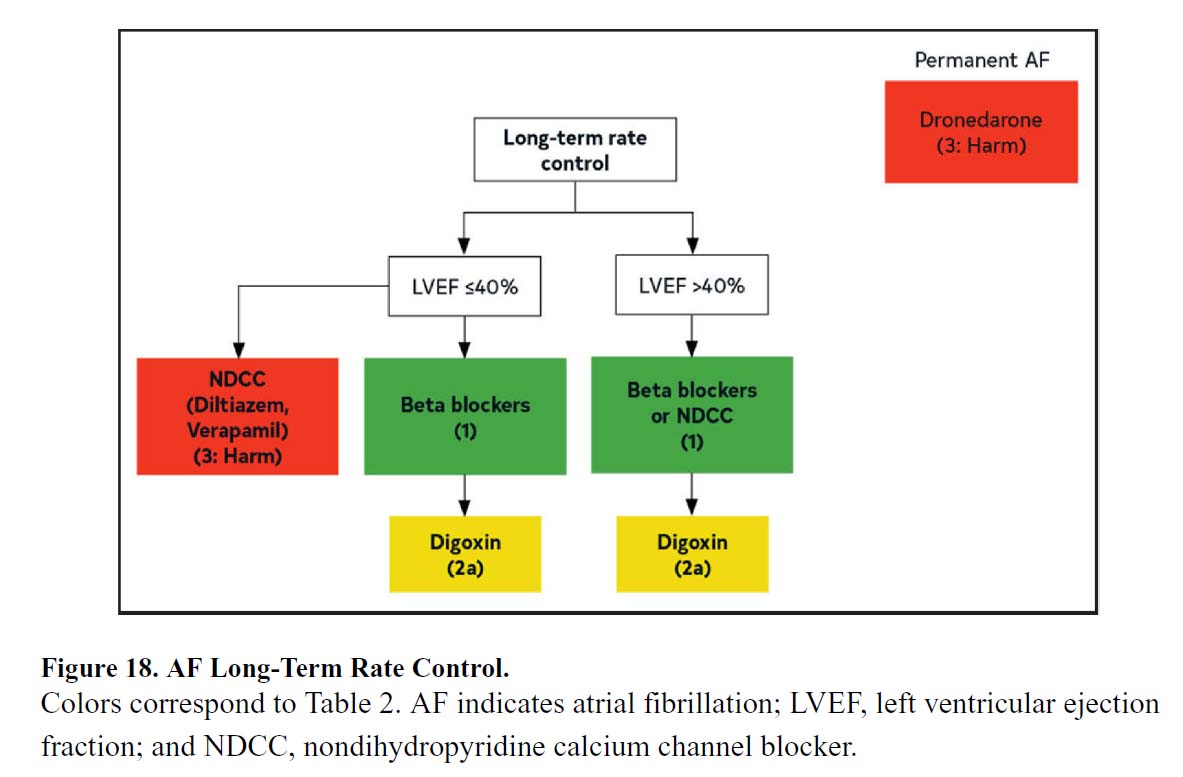 文献1】より
文献1】より
4)リズムコントロール
心房細動のリズムコントロールは、抗不整脈薬またはカテーテルアブレーションによる除細動によって達成できます。心房細動の診断後1年目に心血管合併症のリスクが高まることを考えられ、早期心房細動として知られるため、この期間内の早期リズムコントロールが有益な戦略として浮上しています。EAST-AFNET 4試験では、早期心房細動合併心血管疾患の患者2789人を5年間の追跡調査で無作為化し、早期リズムコントロール療法がレートコントロール戦略と比較して、心血管死、脳卒中、または心不全または急性冠症候群の入院の複合結果を減少させることが明らかになりました(HR 0.79)。同様に、いくつかの研究で心房細動管理のためのリズムコントロール開始時期が重要である事がまとめて確認されました。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.左室心機能が低下し、心房細動が持続する患者では、心房細動が左心室機能の低下に寄与しているかどうかを評価するために、リズムコントロールを試す事を推奨します。 | 1 | B-R |
| 2.症候性心房細動の患者では、リズムコントロールが症状の改善に役立つ可能性があります。 | 2a | B-R |
| 3.最近心房細動と診断された患者(発症後1年以内)では、リズムコントロールが入院、脳卒中、および死亡率を減らすのに役立ちます。 | 2a | B-R |
| 4.心不全合併心房細動患者では、リズムコントロールは、心不全および心筋虚血による死亡率や入院などの症状の改善および転帰の改善に役立ちます。 | 2a | B-R |
| 5.心房細動の患者では、リズムコントロール戦略が心房細動進行の可能性を減らすのに役立ちます。 | 2a | B-NR |
| 6.心房細動に関連する症状が不確かな心房細動の患者では、リズムコントロールの試験(例、除細動または薬理学的療法)は、症状が心房細動に起因するかどうかを判断するのに役立つ場合があります。 | 2b | C-LD |
| 7.心房細動の患者では、リズムコントロール戦略が 認知症の発症または心臓の構造異常の悪化の可能性を減らすのに役立ちます。 | 2b | B-NR |
a. 電気的および薬理学的除細動
洞調律を回復するためのリズムコントロール戦略には、電気的と薬理学的除細動があります。電気的除細動は、迅速性と有効性を考えると、心房細動に起因する血行動態の不安定性を持つ患者に最適な治療法です。血行動態が安定した心房細動患者では、電気的除細動と薬理学的除細動のいずれかを選択することが許容されます。電気的除細動は、薬理学的除細動単独よりも効果的ですが、麻酔または鎮静が必要です。電気的除細動と薬理学的除細動を行う場合は血栓塞栓症のリスクがあるため、抗凝固療法の適応を考慮する必要があります。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.心房細動の持続時間が48時間未満の患者では、血栓塞栓症のリスクは均一ではなく、除細動を行う前に、3週間の抗凝固療法を開始し、さらに心臓内血栓を除外するために画像評価を行う事が推奨されます。 | 1 | B-R |
| 2.48時間以上持続する心房細動患者では、除細動前に抗凝固療法を確立する必要があります。血栓塞栓症を防ぐために、4週間以上抗凝固療法を継続する必要があります。 | 1 | B-NR |
| 3.画像評価で左心房に血栓が検出された場合は、除細動を延期し、抗凝固療法を開始し、少なくとも3-6週間継続する必要があります。 | 1 | C-LD |
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.除細動が必要な心房細動患者には、血栓塞栓症リスク低減のため、ワルファリンよりもDOACが推奨されます。 | I | A |
| 2.症状のある持続性心房細動は、リズムコントロールの一環として、除細動(電気的除細動または薬物除細動)を検討すべきです。 | IIa | B |
| 3.血行動態が悪化していない患者では、心房細動発症後48時間以内に洞調律へ自然に戻る可能性があるため、即時除細動を行うのではなく、経過観察を検討すべきです。 | IIa | B |
| 4.血栓塞栓症リスクのある心房細動患者では、心血管死または入院リスクを低減するため、診断後12ヶ月以内にリズムコントロール戦略の実施を検討すべきです。 | IIa | B |
| 5.心房細動の持続時間が24時間を超える場合、または自然に洞調律へ戻ることを待つ余地がある場合、適切な抗凝固療法または経食道心エコー検査を実施せずに早期の除細動を行うことは推奨されません。 | III | C |
b. 電気的除細動
迅速性と有効性を考えると、電気的除細動は血行動態が不安定な心房細動の患者に最適な治療法です。薬理学的除細動単独と比較して、同期直流除細動による電気的除細動は、心房細動から洞調律を回復するのにより迅速で効果的です。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.心房細動に起因する血行動態の不安定性のある患者では、洞調律を回復するために即時の電気的除細動を実施する必要があります。 | 1 | C-LD |
| 2.血行動態が安定している心房細動患者では、電気的除細動を最初のリズムコントロール戦略として、または薬理学的除細動が失敗した後に実行できます。 | 1 | B-R |
| 3.心房細動の患者では、電気的除細動を行う場合、心室細動を誘発するリスクを減らすため、エネルギー供給がQRSに同期していることを確認する必要があります。 | 1 | C-LD |
| 4.心房細動の患者では、電気的除細動を行う場合、少なくとも200Jを初期エネルギーとして使用することが推奨されます。 | 2a | B-R |
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.血行動態が急激に悪化したり、不安定な心房細動患者には、患者の即時的な転帰を改善するために、電気的除細動が推奨されます。 | I | C |
| 2.心房細動に対して電気的除細動を行う前に、少なくとも3週間の経口抗凝固療法を行うことが推奨されます。これは、処置関連血栓塞栓症を予防するためです。 | I | A |
| 3.3週間の経口抗凝固療法が行われていない場合は、心筋血栓を除外し早期電気的除細動を可能にするために、経食道心エコー検査が推奨されます。 | I | A |
| 4.血栓塞栓症を予防するため、電気的除細動後、すべての患者で少なくとも4週間、また血栓塞栓症リスク因子を有する患者では洞調律の達成の有無にかかわらず長期間、経口抗凝固療法を継続することが推奨されます。 | I | A |
| 5.心房細動の持続時間が24時間を超える場合、または自然に洞調律に戻るのを待つ余裕がある場合は、適切な抗凝固療法または経食道心エコー検査を実施せずに早期電気的除細動を行うことは推奨されません。 | III | C |
c. 薬理学的除細動
薬理学的除細動は、血行動態的に安定している新規発症または持続性の心房細動の患者で、電気的除細動が望ましいが禁忌の場合に適応されます。イブチリド(日本未承認)は、心房細動の薬理学的除細動に迅速に機能しますが、特にHFrEF(収縮機能が低下した心不全)患者では、QT間隔の延長とトルサードドポワントに関連しています。アミオダロンの静脈内投与は、イブチリドよりも心房細動変換に長い時間を必要とします。静脈内プロカインアミドは、心房細動の薬理学的変換に対してプラセボよりも効果的ですが、イブチリドよりも効果が低くなります。ドフェチリド(日本未承認)、経口アミオダロン、および経口ソタロールは、心房細動から洞調律への変換に効果的であることが示されていますが、有効性には数日かかるため、急性薬理学的除細動の実用的な選択肢ではありません。フレカイニドとプロパフェノンは、心房細動から洞調律への変換に効果的ですが、不整脈のリスクがあるため、構造的心疾患または心不全には禁忌です。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.心房細動の患者にとって、薬理学的除細動は、血行動態が安定している人、または電気的除細動が好ましいが実施できない状況にある人にとって、電気的除細動の代替手段として合理的です。 | 2a | C-LD |
| 2.心房細動の患者の場合、イブチリドは、抑制されたLV機能(LVEF <40%)のない患者の薬理学的除細動に合理的です。 | 2a | A |
| 3.心房細動の患者の場合、静脈内アミオダロンは薬理学的除細動に合理的ですが、変換までの時間は一般に他の薬剤よりも長くなります(8-12時間)。 | 2a | A |
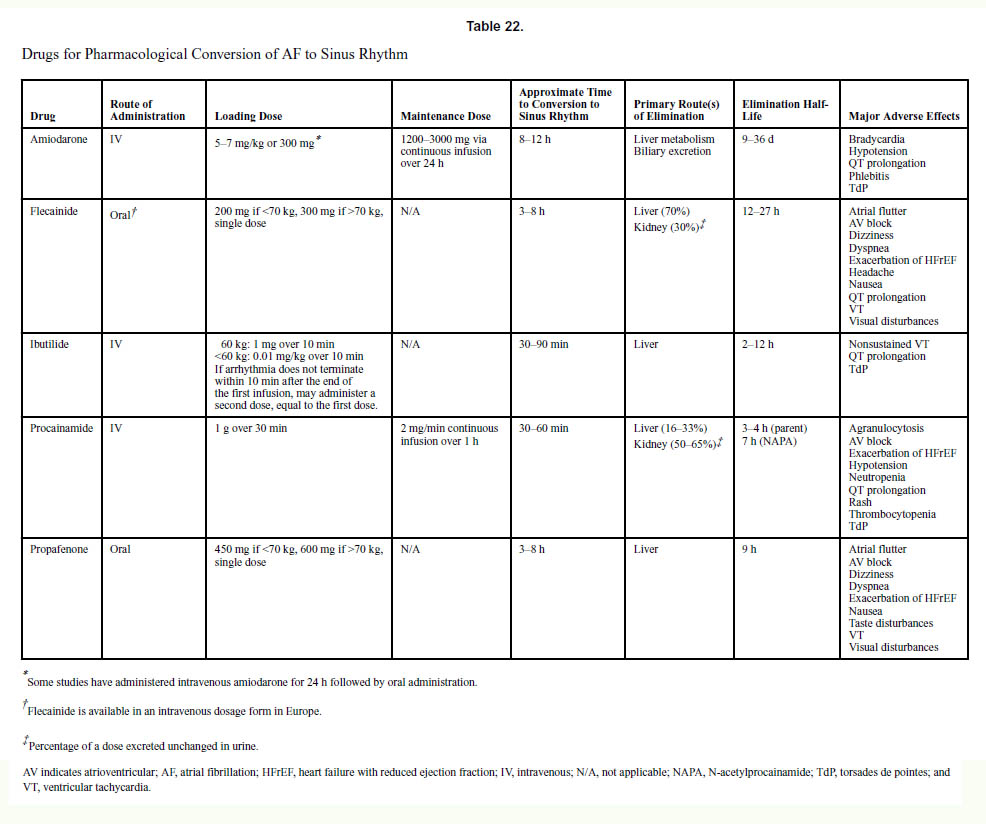 文献1】より
文献1】より
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.最近発症した心房細動に対する薬理学的除細動が望ましい場合、フレカイニドまたはプロパフェノンの静脈内投与が推奨されます。ただし、重度の左室肥大、HFrEF(収縮機能が低下した心不全)、または冠動脈疾患を有する患者は除きます。 | I | A |
| 2.最近発症した心房細動に対する薬理学的除細動が望ましい場合、ベルナカラントの静脈内投与が推奨されます。ただし、最近発症した急性冠症候群、HFrEF、または重度の大動脈弁狭窄を有する患者は除きます。 | I | A |
| 3.重度の左室肥大、HFrEF、または冠動脈疾患を有する患者における心房細動に対する除細動が望ましい場合、除細動の遅延が生じる可能性があることを承知の上で、アミオダロンの静脈内投与が推奨されます。 | I | A |
| 4.洞結節機能不全、房室伝導障害、QTc延長(>500ms)を有する患者には、催不整脈および徐脈のリスクが考慮されない限り、薬理学的除細動は推奨されません。 | III | C |
d. 洞調律リズム維持のための抗不整脈薬
洞調律リズム維持のための抗不整脈薬投与は、カテーテルアブレーションの候補ではなかったり、カテーテルアブレーションを辞退したり、抗不整脈療法を好む心房細動患者の洞調律の長期維持に合理的です。フレカイニドとプロパフェノンは、洞調律の維持に効果的ですが、不整脈のリスクがあるため、構造的心疾患または心不全には禁忌です。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.HFrEF(収縮機能が低下した心不全)を合併した心房細動患者は、洞調律の長期維持のためにドフェチリド#(日本未承認)またはアミオダロネット*による治療が妥当です。 | 2a | A# B-NR* |
| 2.心筋梗塞の既往がなく、重大な構造的心疾患にない心房細動の患者では、トレカイニドまたはプロパフェノンの使用は、 洞調律リズム維持のために合理的です。 | 2a | A |
| 3.正常な心機能を有する心房細動患者の場合、低用量アミオダロン(100-200 mg/日)の使用は、洞調律リズム維持のために合理的ですが、その副作用プロファイルを考慮すると、他のリズム制御戦略が無効であったり、禁忌の場合に投与すべきです。 | 2a | A |
| 4.ベースラインのQT間隔の延長が有意でなく、低カリウム血症、低マグネシウム血症、徐脈のない心房細動患者の場合、 ソタロールの使用を洞調律の長期維持のために検討することができます。使用後は定期的に腎機能とQT間隔、心拍数、血清カリウム/マグネシウム濃度をチェックすべきです。 | 2b | A |
| 5.心筋梗塞の既往があったり、重大な構造的心疾患を合併した心房細動の患者では、心不全の悪化、潜在的な不整脈、死亡率の増加のリスクがあるため、フレカイニドおよびプロパフェノンを、投与しないでください。 | 3:harm | B-R |
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.心房細動およびHFrEF(収縮機能が低下した心不全)の患者には、心房細動の再発および進行を予防するために長期抗不整脈薬療法が必要であり、心臓外毒性について慎重に検討およびモニタリングしながら、アミオダロンが推奨されます。 | I | A |
| 2.ドロネダロンは、HFmrEF(収縮機能が中等度の心不全、40%≦ LVEF <%50%)、HFpEF(収縮機能が保たれた心不全、LVEF ≧40%)、虚血性心疾患、または弁膜疾患を有する患者を含む、長期のリズムコントロールを必要とする心房細動患者において、心房細動の再発および進行を予防するために推奨されます。 | I | A |
| 3.フレカイニドまたはプロパフェノンは、左室収縮機能障害、重度の左室肥大、冠動脈疾患を有する患者を除き、心房細動の再発および進行を予防するために長期のリズムコントロールを必要とするAF患者において推奨されます。 | I | A |
| 4.抗不整脈薬療法は、抗徐脈ペーシングが行われない限り、進行した伝導障害を有する患者には推奨されません。 | III | C |
f. 経口アミオダロンを服用している患者でモニタリング
経口アミオダロンを服用している患者では以下のモニタリングが推奨されています。アミオダロンには重量で37%のヨウ素が含まれているため、患者の2%から24%で甲状腺の異常が生じる可能性があります。ある研究では、アミオダロン誘発性甲状腺機能低下症の発症までの期間の中央値は183日で、甲状腺機能亢進症の発症の中央値は720日でした。定期的な甲状腺機能チェックが必要です。経口アミオダロンは、肝臓トランスアミナーゼの上昇を引き起こし、まれに肝毒性を引き起こす可能性もあります。アミオダロンは、間質性肺疾患または過敏症症候群の形で肺毒性を引き起こす可能性があり、頻度は内服者の1%から2%で、症例の約10%で致命的となります。したがって、定期的な胸部X線検査が、推奨されます。アミオダロンの服用中に原因不明の咳嗽や呼吸困難を発症した患者では、胸部CTスキャンが診断に役立ちます。角膜微小沈着物(上皮性角膜症)はアミオダロン投与後に見られますが、視覚異常や光過敏症はまれです。したがって、眼科検査は、視覚異常が発症した場合にのみ合理的です。アミオダロンはまた、末梢神経障害に関連しています。経口アミオダロンはトルサード・ド・ポワントを引き起こす可能性があります。
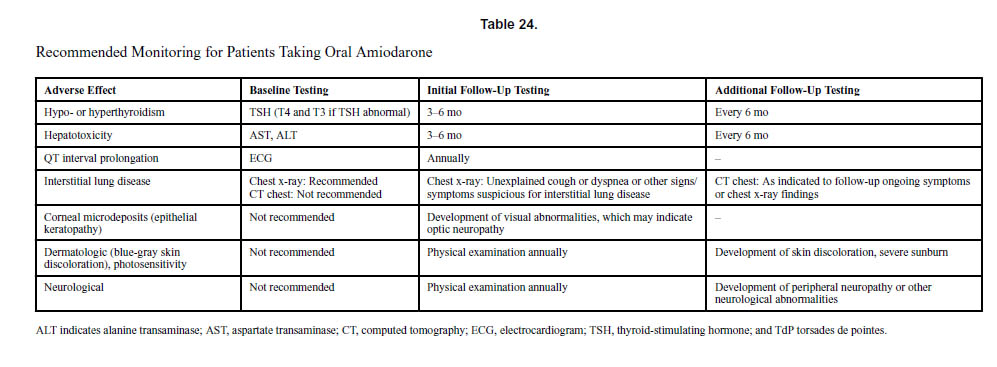 文献1】より
文献1】より
g. カテーテルアブレーション
カテーテルアブレーションは、複数の二重盲検試験と大規模なレジストリからの証拠により、心房細動の確立された治療法となり、新しい技術が開発されるにつれて進化し続けています。最近の情報によると、心房細動のアブレーションは、持続性心房細動と発作性心房細動の両方に対して抗不整脈薬よりも効果的であることが示されています。現在、高周波、クライオバルーン、レーザーバルーン、ホットバルーン、パルスフィールド、ハイブリッドアブレーションなど、いくつかのアブレーション方法が存在します。高周波アブレーションは、確立された効果的で安全な技術であり、熱エネルギーを使用して心臓組織をアブレーションします。温度制御された高周波エネルギーに最適化された接触力感知カテーテルの最近の導入により、その性能はさらに向上しましたが、多くの場合、より多くの手順が必要になります。対照的に、極低温を使用するクライオバルーンアブレーションは、手技の時間を短縮しながら、ラジオ波アブレーションに匹敵する結果を提供しますが、横隔神経麻痺のリスクが高くなります。パルスフィールド アブレーションは、電気パルスを使用して心臓組織を選択的に標的とする新しい技術であり、クライオバルーンアブレーションと比較して、処置時間が短く、合併症が少ないため、有望な有効性と安全性の結果を示していますが、その機器の高コストが障壁になる可能性があります。低侵襲手術とカテーテルベースの技術の両方を統合したハイブリッドアブレーションは、カテーテルアブレーションのみと比較して、洞調律の維持に優れた有効性を示しています。しかし、このアプローチは、合併症の発生率が高く、コストが高く、処置時間が長くなることが知られています。肺静脈隔離術は、現在、心房細動のカテーテルアブレーションにおける主要なアプローチです。610人の患者を対象とした6つの無作為化臨床試験からなるメタアナリシスで、1年間の追跡期間中に肺静脈隔離術を受けた患者の心房細動の再発は、他のアブレーション戦略と比較して有意に低かったことがわかりました。
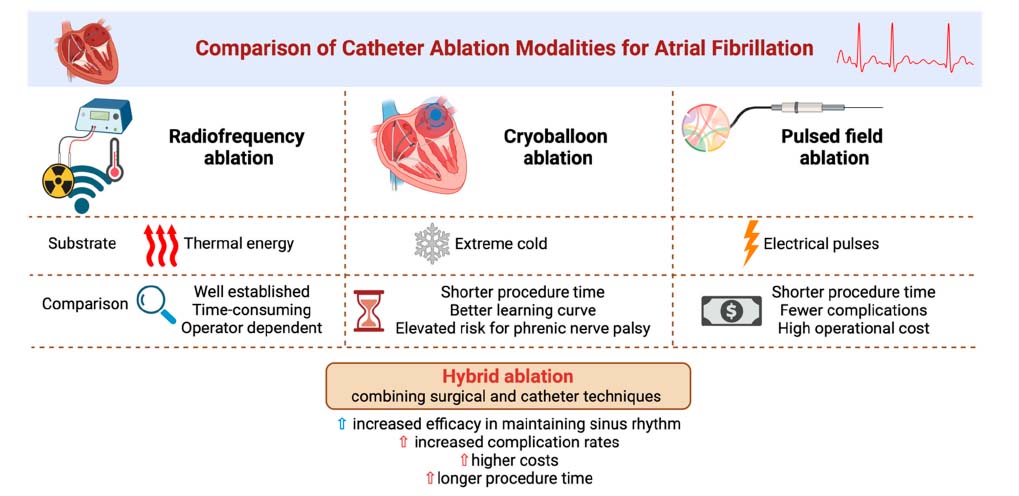 文献3】より
文献3】より
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.抗不整脈薬は効果がなかったり、禁忌であったりする症候性心房細動の患者では、 カテーテルアブレーションは継続的なリズムコントロールを達成し、症状を改善するのに役立ちます。 | 1 | A |
| 2.リズムコントロールが望まれる症候性発作性心房細動の選択された患者(一般的には若年で併存疾患が少ない)では、カテーテルアブレーションは症状を改善し、持続性心房細動への進行を減らすための治療第一選択療法として有用です。 | 1 | A |
| 3.心房粗動の患者では、カテーテルアブレーションは症状の改善に役立ちます。 | 1 | A |
| 4.無症候性または軽症の心房細動の選択された患者では、カテーテルアブレーションは心房細動とそれに関連する合併症の進行を減らすのに役立つ可能性があります。 | 2b | B-R |
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.発作性心房細動患者における共同意思決定リズムコントロール戦略において、カテーテルアブレーションは、心房細動の症状、再発、および進行を軽減するために、第一選択の選択肢として推奨されます。 | I | A |
| 2.心房細動に対するカテーテルアブレーションを検討する際には、手技上のリスク、想定されるベネフィット、および心房細動再発の危険因子を考慮し、共同意思決定が推奨されます。 | I | C |
| 3.抗不整脈薬療法に抵抗性または不耐症の発作性または持続性心房細動患者には、心房細動の症状、再発、および進行を軽減するためにカテーテルアブレーションが推奨されます。。 | I | A |
| 4.頻脈誘発性心筋症の可能性が高い心房細動合併HFrEF(収縮機能が低下した心不全)患者には、左室機能不全を改善するために心房細動カテーテルアブレーションが推奨されます。 | I | B |
h. カテーテルアブレーション後の再発心房細動の管理
心房細動の再発は、最初のアブレーション処置後によく見られ、現代の臨床試験では患者の30%から40%に発生しています。一般的な米国の診療では、de novo アブレーションを受けている患者の11%が1年までにアブレーションを繰り返しています。カテーテルアブレーション後に再発した場合でも、アブレーションを再度行う事により症状やQOLの改善を実感することが多いです。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1. カテーテルアブレーション後に症候性心房細動が再発した患者では、カテーテルアブレーションの反復療法や抗不整脈薬療法が症状の改善や心房細動からの解放に有用です。 | 1 | B-NR |
| 2. 心房細動のカテーテルアブレーションを受けた患者さんの中には、アブレーション後の短期的な抗不整脈薬療法が心房性不整脈の早期再発や入院を減らすために有用な場合があります。 | 2a | A |
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.初回カテーテルアブレーション後に心房細動が再発した患者では、心房細動の症状、再発、および進行を軽減するために、カテーテルアブレーションの再施行を考慮するべきです。 | IIa | B |
| 2.抗不整脈薬に抵抗性で、経皮カテーテルアブレーション戦略が失敗した症状のある発作性心房細動患者では、電気生理学者と外科医が共同で意思決定を行うリズムコントロールチーム内で、心房細動の症状、再発、および進行を予防するために、再度のカテーテルアブレーションまたはハイブリッドアブレーション手技が考慮される場合があります。 | IIb | B |
| 3.抗不整脈薬に抵抗性で、経皮カテーテルアブレーション戦略が失敗した症状のある持続性心房細動患者では、電気生理学者と外科医が共同で意思決定を行うリズムコントロールチーム内で、心房細動の症状、再発、および進行を予防するために、再度のカテーテルアブレーションまたはハイブリッドアブレーション手技が考慮される場合があります。 | IIa | A |
i. カテーテルアブレーション前後の抗凝固療法
カテーテルアブレーション後の合併症はまれですが、アブレーション後に血栓塞栓性イベントのリスクが増加します。アブレーション後最初の30日間の脳卒中のリスクは0.8%です。したがって、カテーテルアブレーション処置前、処置中、および処置後の経口抗凝固療法が最も重要です。
| 米国のガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.心房細動のカテーテルアブレーションを受けているワルファリンを服用している患者では、カテーテルアブレーションは中断のない治療的抗凝固療法(INRを2.0-3.0目安に)で実施する必要があります 。 | 1 | B-NR |
| 2.心房細動のカテーテルアブレーションを受けているDOACの患者では、カテーテルアブレーションは、連続的または最小限の中断で行う必要があります。 | 1 | A |
| 3.心房細動のカテーテルアブレーションを受けた患者では、経口抗凝固療法を少なくとも施術後3か月間継続する必要があります。 | 1 | B-NR |
| 4.心房細動のカテーテルアブレーションを受けた患者では、長期の経口抗凝固療法の継続は、患者の脳卒中リスクに応じて指示する必要があります(CHA2DS2-VAScスコアなど)。 | 1 | B-NR |
| ヨーロッパのガイドライン | 推奨度 | エビデンスレベル |
|---|---|---|
| 1.カテーテルアブレーションを受ける患者には、術中虚血性脳卒中および血栓塞栓症を予防するため、経口抗凝固薬の継続投与が推奨されます。 | I | A |
| 2.血栓塞栓症リスクが高い心房細動患者においては、洞調律に戻ったか否かや左心耳血栓の有無にかかわらず、カテーテル、またはハイブリッドアブレーション後も、虚血性脳卒中および血栓塞栓症を予防するために経口抗凝固療法の継続が推奨されます。 | I | C |
| 3.血栓塞栓症リスクが高い心房細動患者では、術中虚血性脳卒中および血栓塞栓症を予防するため、カテーテルアブレーションの少なくとも3週間前から経口抗凝固薬の投与を開始することが推奨されます。 | I | C |
| 4.虚血性脳卒中および血栓塞栓症を予防するため、アブレーション後も、アブレーション手技の成功率ではなく、患者のCHA2DS2-VAスコアに基づいて経口抗凝固薬の継続が推奨されます。 | I | C |
j. カテーテルアブレーション後の合併症
心房細動カテーテルアブレーションの合併症は、患者の約5%で発生し、そのほとんどが血管合併症です。ただし、生命を脅かすいくつかの合併症が発生する可能性があります。最も重篤な合併症は左心房から食道への穿孔であり、これはしばしば致命的ですが、非常にまれです。別の生命を脅かす合併症は心膜タンポナーデですが、これは通常、迅速な心膜穿刺で治療できます。臨床的に重要な脳卒中とTIAは、患者の<1%で観察されます。アブレーション中の死亡は通常、タンポナーデによるものですが、脳卒中でも発生する可能性があります。
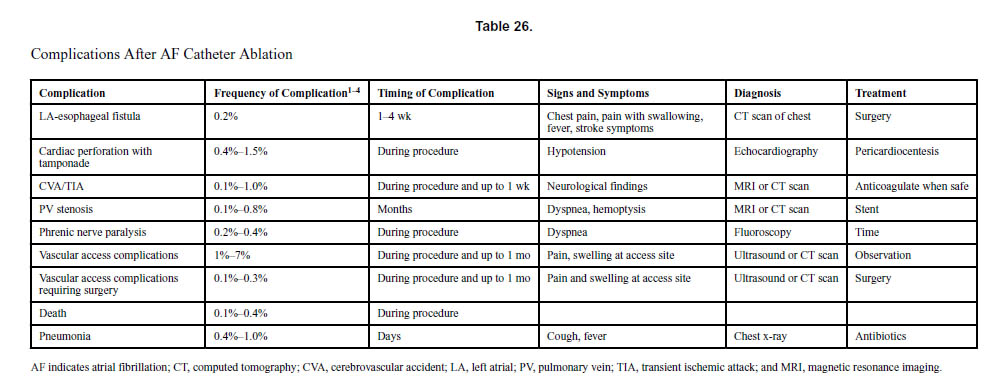 文献1】より
文献1】より
文献
1】2023 ACC/AHA/ACCP/HRS Guideline for the Diagnosis and Management of Atrial Fibrillation: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2024;149: e1-e156. doi:10.1161/CIR.0000000000001193.
心房細動の診断と管理のための 2023年米国心臓病学会(American College of Cardiology:ACC)/米国心臓協会(American Heart Association:AHA)/米国臨床薬理学会(American College of Clinical Pharmacy:ACCP)/ハートリズムソサエティ(Heart Rhythm Society:HRS) ガイドライン
2】2024 ESC Guidelines for the management of atrial fibrillation developed in collaboration with the European Association
for Cardio-Thoracic Surgery (EACTS). European Heart Journal 2024;45:3314-3414
https://doi.org/10.1093/eurheartj/ehae176
3】Advances in Atrial Fibrillation Management: A Guide for General Internists. J. Clin. Med. 2024, 13, 7846. https://doi.org/10.3390/jcm13247846
4】Comparison of the Latest ESC, ACC/AHA/ACCP/HRS, and CCS Guidelines on the Management of Atrial Fibrillation. JACC Clin Electrophysiol 2025 Apr;11:836-849.
doi: 10.1016/j.jacep.2024.12.018. Epub 2025 Feb 19.
<<2025年9月18日作成>>