不定愁訴とトラウマ
2025年2月28日号の日経メディカルに不定愁訴に関するミニ特集が掲載されました。4本目の記事が「その不定愁訴、根本原因はトラウマかも・・・?」というものでした。確かに当院に通院されている慢性疼痛の患者さんにはトラウマをかかえていらっしゃる方が多く、疼痛のほかにも、倦怠感、しびれ、めまい、かゆみ、咳といった不定愁訴を伴うことが多いです。そこで、今回は不定愁訴(身体症状)とトラウマの関連について調べてみました。
不定愁訴とは、「全身倦怠感、易疲労性、頭重、動悸、息切れ、手足のしびれ感、食欲不振、胃のもたれ、腹部不快感など、漠然とした身体的愁訴で、 しかもそれに見合うだけの器質的疾患の裏づけがない場合」を指します。英語では、medically unexplained symptoms(医学的に説明困難な身体症状)、functional somatic syndromes (機能性身体症候群)などと表現されています。
見逃されやすい不定愁訴の原因疾患
トラウマの話の前に、一般の検査で見逃されがちな不定愁訴の原因となる器質的疾患をいくつかピックアップします。
(1)甲状腺機能低下症(橋本病など)
症状としては、倦怠感、便秘、浮腫、寒がり、嗄声などがありますが、無症状の事も多いです。FT4、TSHなどの甲状腺関連ホルモンを測定すれば診断がつきます。
(2)甲状腺機能亢進症(バセドウ病など)
症状としては、多汗、動悸、手の震え、暑がり、軟便、食欲亢進(体重は増える事も減る事もあります)、眼球突出などがあります。FT4、TSHなどの甲状腺関連ホルモンを測定すれば診断がつきます。
(3)副腎皮質機能低下症(アディソン病など)
症状としては、色素沈着、倦怠感、腹部違和感などがあります。コルチゾール、ACTHなどの副腎皮質関連ホルモンを測定すれば診断がつきますが、場合によっては負荷試験が必要な事があります。
(4)下垂体前葉機能低下症によるACTH欠乏症
症状としては、全身倦怠感、食欲不振、体重減少、低血圧、皮膚蒼白、腋毛・恥毛の脱落などがあります。コルチゾール、ACTHなどの副腎皮質関連ホルモンを測定すれば診断がつきますが、場合によっては負荷試験が必要な事があります。
(5)シェーグレン症候群
症状としては、ドライアイ、口腔乾燥、全身倦怠感、関節痛、微熱、頭痛、皮膚の乾燥、日光過敏などがあります。血液検査では抗SS-A抗体や抗SS-B抗体が陽性となりますが、陰性でもシェーグレン症候群の可能性は否定できません。リウマチ専門医の受診をお勧めします。
不定愁訴(身体症状)と精神神経疾患
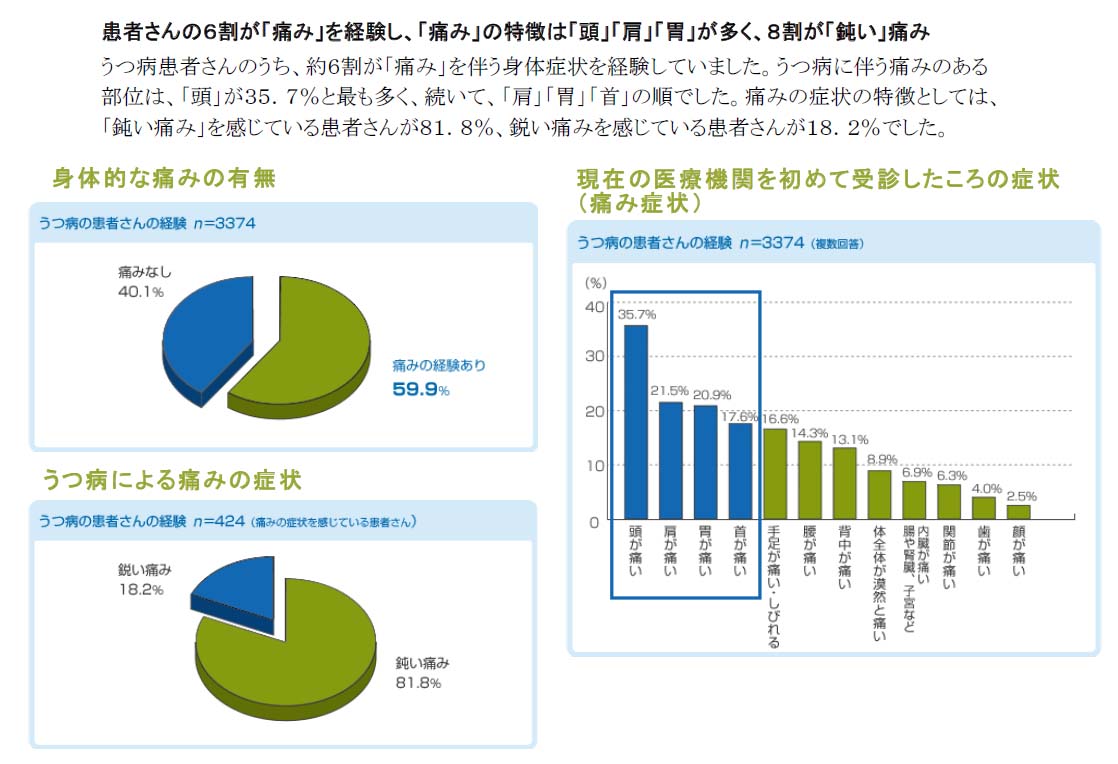
上記の検査を施行しても何の異常も見られない場合は、不定愁訴の背景に精神-身体関連因子が関わっている可能性を考慮する必要があります。たとえば、うつ病患者さんのうち約60%が「痛み」を伴う身体症状を経験していたという報告があります。
トラウマに関しては、ドイツで小児期の虐待後にPTSD(心的外傷後ストレス障害:Post Traumatic Stress Disorder)と診断された患者の合併症に関しての報告があります。38.5%がパーソナリティ障害(最も多いのは境界性パーソナリティ障害、全例の20%)と診断され、37.4%が身体表現性障害と診断され(最も多いのが身体性疼痛障害、全例の23.8%)、30%が解離性障害と診断されました。PTSD患者の4割近くに疼痛を主とする身体症状が認められているのです。一般に、PTSDでは、一般的な身体症状の増加、具体的には、長引く痛み、心血管疾患、皮膚疾患、肺疾患、代謝性疾患、胃腸症状がより頻繁に報告されています。
トラウマはどうして身体症状を引き起こすか?
PTSDと身体症状の同時発生については明確な証拠がありますが、これらの関連性の根本的なメカニズムは依然として物議を醸しております。脳神経科学的見地、炎症/免疫学的見地から文献を参照して、メカニズムについてまとめてみました。多少私の意見も入っています。
脳神経科学の見地より
扁桃体、海馬、前頭前野
PTSDに最も関連する脳領域には、扁桃体、海馬、島皮質、前頭前野の領域が含まれます。特に注目されるのは扁桃体です。扁桃体は、感情処理と恐怖条件付けで知られる脳の領域で、慢性痛患者では痛みの持続においても重要な働きをしています。
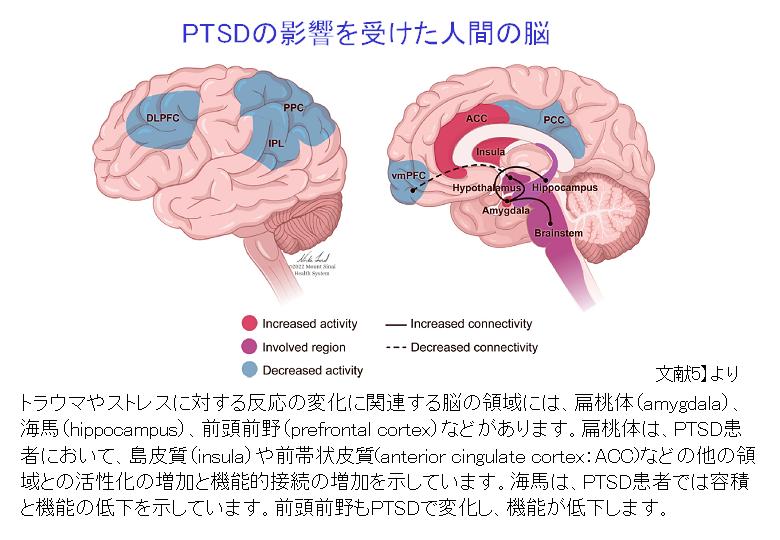
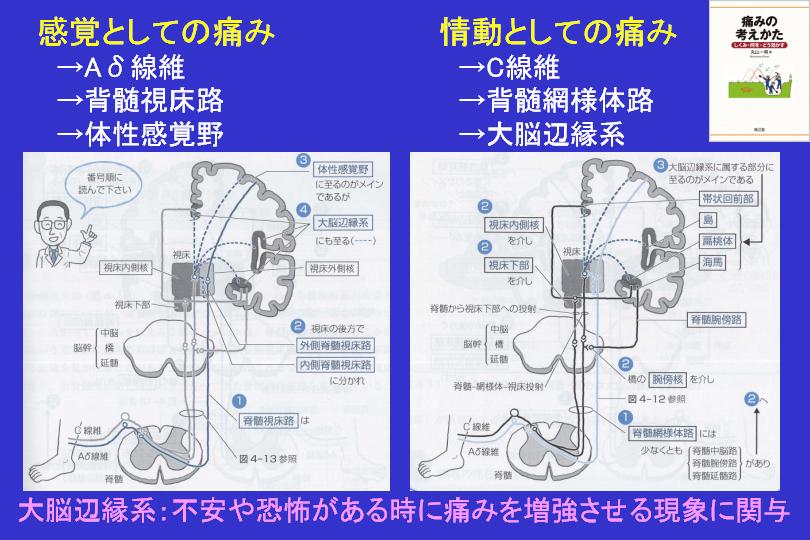
現在では、条件刺激によってもたらされた感覚情報は、扁桃体の側方核と基底外側核で受け取られ、嫌悪情報と痛みの情報に統合され、シナプス活動が長期にわたって増強されて、恐怖記憶へとつながっていくことがわかっています。恐怖記憶の固定化は、グルタミン酸作動性NMDA依存性メカニズム、脳由来神経向性因子(BDNF)、カルシウム依存性メカニズムなど、神経の可塑性に関与する多数の分子メディエーターに依存しています。これらの事象は、扁桃体内のシナプス活動の増強と長期的な構造変化をもたらし、その結果、扁桃体の活性化だけでなく、多くの下流経路の活性化をもたらすことになります。これらの活性化には、視床下部、青斑核、背側迷走神経への投射による心拍数の増加(動悸)、上腕傍接続による呼吸数の増加(呼吸促迫)、背側迷走神経接続による胃腸運動の低下(胃もたれ)、視床下部の脳室傍核への投射による視床下部-下垂体-副腎(HPA)軸の活性化が含まれます。島皮質でもPTSDにて活性化の増加が見られます。
海馬は記憶の固定化に重要な役割を果たすことで知られる領域です。1995年のBremnerらに始まる複数の研究は、PTSD患者の海馬の体積が健常者よりも小さいと報告しており、この知見は現在、大規模な神経画像のメタアナリシスで再確認されています。ただし、海馬の体積の減少はPTSDの結果なのか、原因なのかに関しては、長年議論の対象となっております。海馬の容積が小さいとPTSDを発症するリスクが高いという報告もあります。いずれにしても、海馬の体積減少は、ストレス反応のリスクの増加と関連し、PTSDに見られるフラッシュバックや悪夢などの記憶の障害にとって重要である可能性が示されています。認知制御と感情制御に関与する前頭前野もPTSDで変化し、機能が低下します。
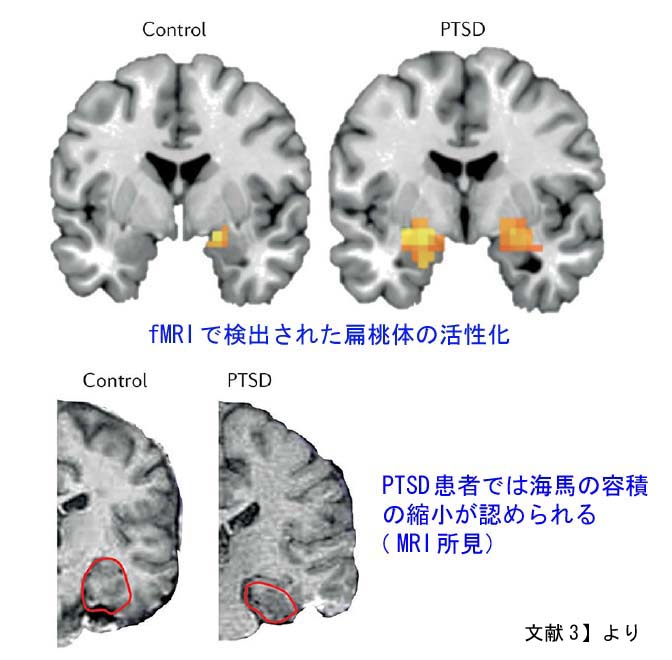
要約すると、PTSDでは、扁桃体、島皮質の活性化の増加、海馬、前頭前野の活性化の減少が認められており、PTSDの痛みなどの身体症状、精神的症状と関連している可能性があります。
視床下部-下垂体-副腎(HPA)軸
トラウマに対する神経生物学的反応における重要な経路の一つは、HPA軸であり、これはストレッサーへの曝露後に急激に活性化されます。視床下部はコルチコトロピン放出ホルモン(CRH)を放出し、それが下垂体に移動し、そこで副腎皮質刺激ホルモン(ACTH)の放出を刺激します。その後、ACTHは副腎皮質に作用して、グルココルチコイドホルモンであるコルチゾールの他、アドレナリン、ノルアドレナリンの放出を引き起こします。急性ストレスが去った後には、コルチゾールは負のフィードバック機構で、視床下部と下垂体を阻害し、CRHとACTHの分泌を抑制し、結果として、アドレナリンのレベルを低下させます。
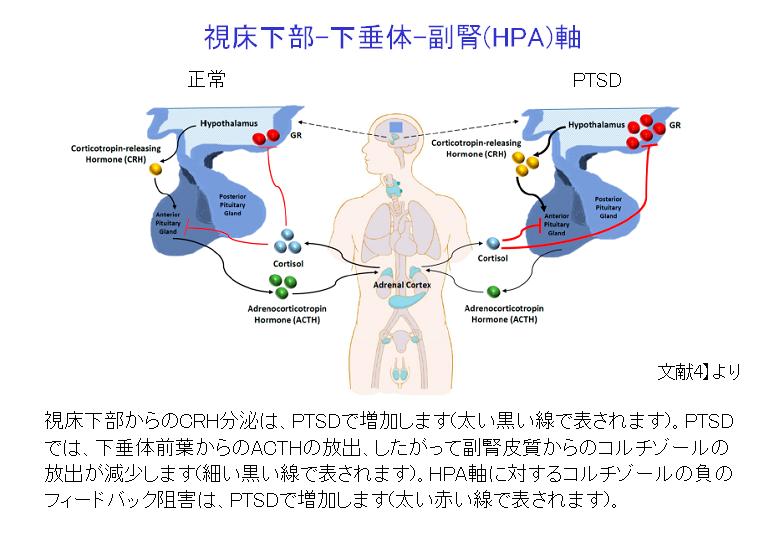
ところが、PTSD患者では、逆説的に、血液中のコルチゾールレベルが低いことがよくあります。前向き研究では、トラウマ的な出来事の前と直後にもコルチゾールレベルが低くなることが示されております。トラウマに対するコルチゾール反応の弱体化が交感神経系の活性化を永続させ、自律神経のバランスが崩れ、PTSDによる精神的症状や身体症状を引き起こす可能性があります。
自律神経系
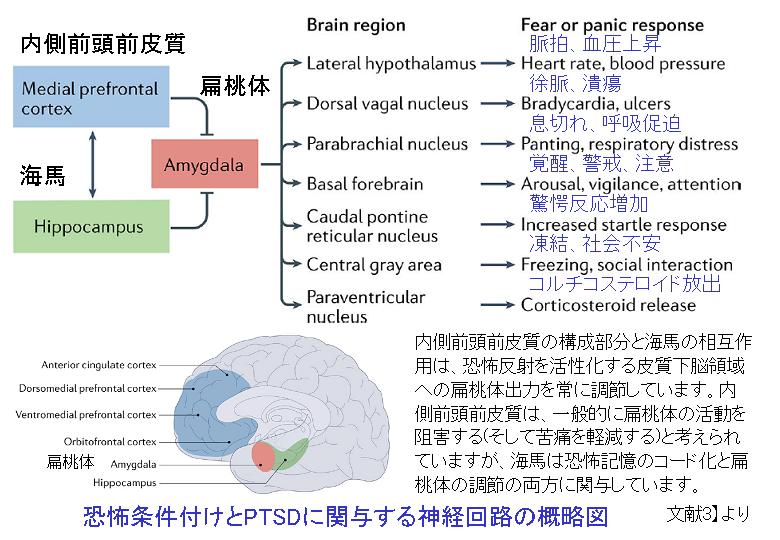
ノルアドレナリンは、自律神経系の重要な伝達物質であり、PTSDに関連する自律神経症状の発症と関連しています。ノルアドレナリンの濃度が高い領域の1つは、青斑核です。青斑核はPTSDに関連する神経化学的活動の中心として機能するストレス反応や覚醒制御の中枢です。臨床的な証拠によると、ノルアドレナリン作動性シグナル伝達の調節不全がPTSDの病態生理学に関与していることを示唆されています。PTSDのノルアドレナリン作動性緊張の増加は、中枢および末梢の交感神経活動の増加から生じ、安静時心拍数と収縮期血圧の増加につながります。
PTSDの症状の多くは、中枢神経系のノルアドレナリン作動性ニューロンの緊張の増加から生じます。ノルアドレナリン活性の増加は、内側前頭前皮質の機能不全(扁桃体の機能調節不全に結びつきます)および恐怖の持続と関連しており、不安およびPTSD症状の重症度と関連がある可能性があります。過剰なノルアドレナリン放出は、扁桃体と青斑核で増加し、扁桃体と青斑核の活動性を上昇させ、侵入症状と自律神経活動亢進をもたらすことがわかりました。ノルアドレナリン作動性機能の変化は、PTSDの睡眠障害にも関連しています。睡眠中の交感神経活動の増加(例えば心拍数の増加)は、PTSD患者に見られます。さらに、急速眼球運動(REM)睡眠中、PTSD患者では、交感神経の緊張が高まっていると報告されています。
ガンマ-アミノ酪酸(GABA)
抑制性神経伝達物質であるGABAは、脳全体に広く分布しています。陽子磁気共鳴分光法の研究では、PTSD患者において、トラウマにさらされた健康な対照と比較して、側頭皮質、頭頂後頭皮質、および島皮質のGABAレベルが低いことが報告されました。極度のストレス時には、GABAの血漿レベルが低いことはPTSDに関連しており、アドレナリン作動性反応調節の過負荷(GABAによる抑制が低下するため)につながる可能性があります。GABAは鎮痛にも関与する神経伝達物質であるため、GABAの減少は慢性痛の発症にも関連する可能性があります。
免疫学の見地から
PTSDはしばしば精神的な疾患として捉えられていますが、免疫系の機能不全や炎症との強い関連性を強調する証拠が増えています。近年、縦断的な研究により、PTSDと、内分泌障害、炎症性関節炎、血管炎、神経系炎症性疾患、消化器系炎症性疾患、膠原病など、さまざまな自己免疫疾患との間に密接な関連性があることが明らかになりました。PTSD患者では、免疫細胞の異常な活性化とサイトカイン、可溶性接着分子、ケモカイン、炎症マーカーのレベルの上昇が頻繁に観察されました。これらの炎症反応は、中枢免疫細胞の異常な活動を伴い、炎症がPTSDの病因に重要な役割を果たしている可能性を示唆しています。このPTSDの「神経炎症仮説」は、最近の基礎研究で徐々に検証されてきました。
サイトカイン
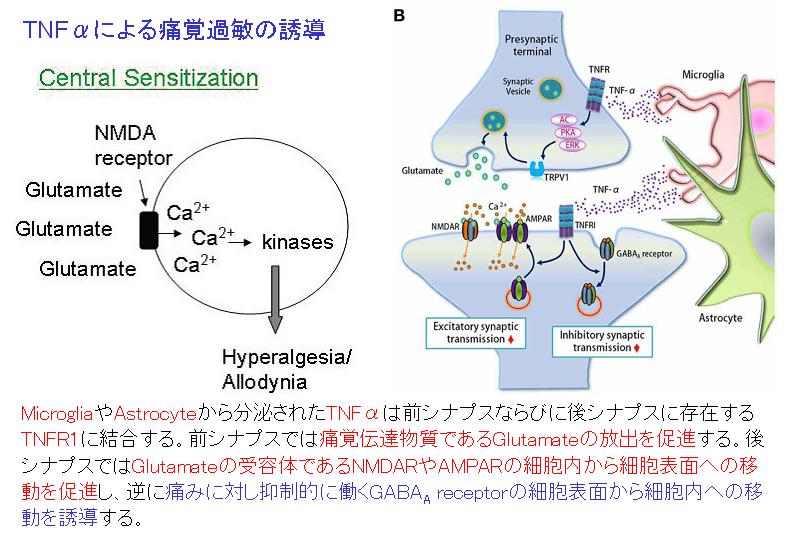
PTSDではサイトカインの異常が指摘されています。サイトカインは細胞の周囲に分泌されるシグナル伝達タンパク質の一種で、病原体に対する免疫防御の調節や組織損傷に対する炎症反応の調節など、免疫応答の調節に重要な役割を果たします。主に末梢免疫細胞(マクロファージ、リンパ球、肥満細胞など)、血管内皮細胞、中枢神経系内の免疫細胞(ミクログリア、アストロサイト、ニューロンなど)から分泌されます。サイトカインは、その機能に基づいて炎症誘発型と抗炎症性タイプに分類され、これらは相互作用して炎症のバランスを調整します。PTSDでは、血液、唾液、脳脊髄液などで炎症誘発性サイトカインと抗炎症性サイトカインの著しい不均衡が認められています。PTSD患者では、インターロイキン(IL)-1β、IL-6、IL-17A、腫瘍壊死因子-α (TNF-α)などの炎症誘発性サイトカインのレベルが有意に上昇していることがわかっています。IL-2、インターフェロン-γといったサイトカインの上昇も見られます。さらに、これらのサイトカインおよび可溶性受容体のレベルは、海馬や前頭前野などの特定の脳領域の構造的および機能的変化と密接に関連していることが研究によって明らかになっています。IL-1β、IL-6、IL-17A、TNF-αといったサイトカインは関節リウマチ、乾癬、血管炎、炎症性腸疾患など炎症性疾患でも上昇しており、治療のターゲットとなっております。TNF-αは痛みの増悪因子としても働きます。PTSD患者で観察される炎症性サイトカインの上昇は、自己免疫疾患および心血管疾患のリスク上昇に寄与する可能性があります。
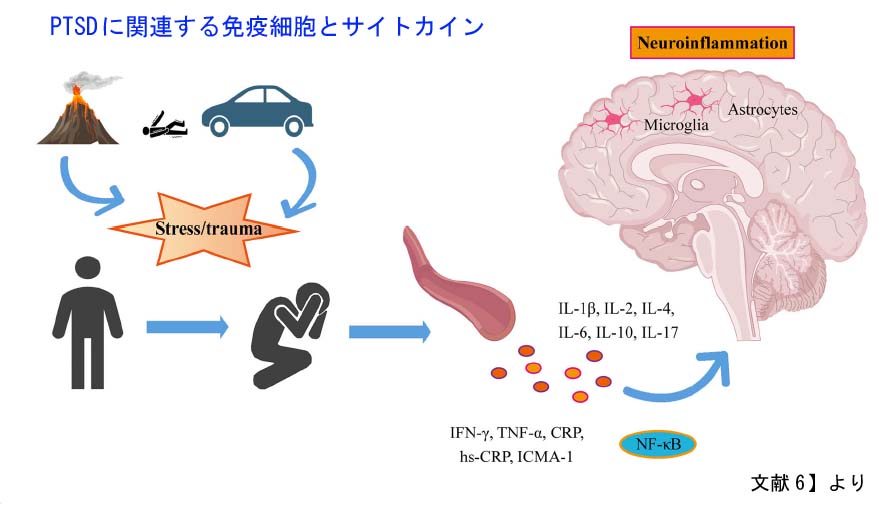
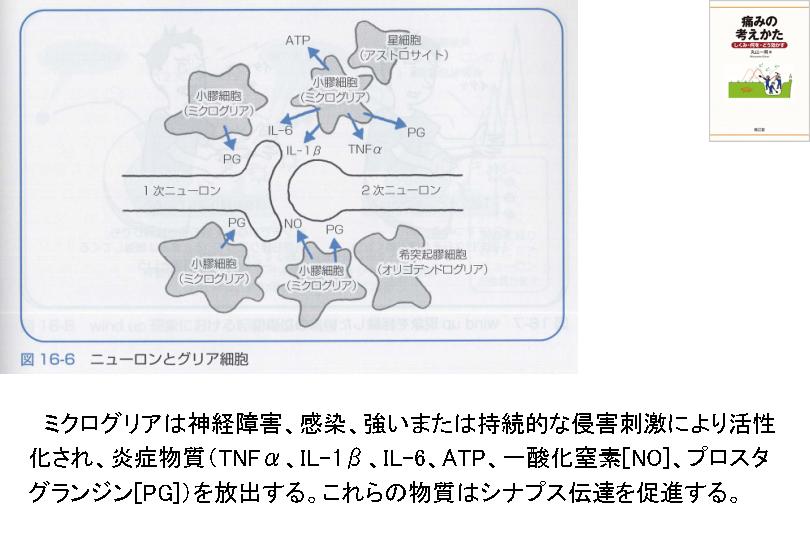
ミクログリア、アストロサイト
ミクログリアは、脳内の特殊な免疫細胞として、脳細胞全体の5%-10%を占めています。それらはマクロファージと同様の食作用機能を有するだけでなく、神経調節にも重要な役割を果たしています。PTSD患者ではミクログリアとアストロサイトの活性化レベルが有意に上昇しています。さらに、末梢免疫細胞や血液中の炎症誘発性サイトカインは血液脳関門を通過して中枢神経系に作用し、ミクログリアをさらに活性化させます。これらの活性化されたミクログリアとアストロサイトは、大量の炎症誘発性サイトカインを放出し、ニューロンの損傷や認知機能障害を引き起こします。この炎症は、主に前頭前野、扁桃体、海馬などの脳領域に集中し、それぞれ感情の調節、記憶の固定化、恐怖の消滅に影響を与えます。ミクログリアは慢性痛における痛みの持続・増強にも関与しています。
陽電子放出断層撮影法(PET)に基づく最近の研究では、PTSDにおける神経炎症の役割がさらに解明されています。例えば、[18F]-FEPPA PET イメージングでは、PTSD患者の海馬と前頭皮質のミクログリア活性化レベルが有意に上昇しており、これは症状の重症度と相関していました。さらに、モノアミンオキシダーゼ-Bプローブ[11C]SL25.1188を使用したPET研究では、PTSD患者のアストロサイト数の大幅な増加が明らかになり、神経炎症の存在を裏付けるさらなる証拠が得られました。
末梢免疫細胞
中枢神経系以外では、末梢免疫系に関する研究により、PTSD患者の免疫不均衡の特徴も明らかになっています。トラウマにさらされた健康な対照と比較して、PTSD患者は末梢白血球、リンパ球、T細胞、およびCD4+ 細胞の数が有意に増加しています。これらのうち、Th1細胞とTh17細胞の割合は増加しますが、制御性T細胞は減少します。他の研究では、PTSD患者におけるCD4+/CD8+ T細胞比の減少が報告されており、CD8+エフェクターT細胞とナイーブT細胞の増加が伴っています。これらの知見は、PTSD患者の末梢免疫系における顕著な炎症誘発へ免疫系を誘導していることを示しています。通常の状況下では、髄液や髄膜に存在する末梢免疫細胞は血液脳関門を通過できず、脳組織に侵入できません。特定の条件下では末梢免疫細胞(マクロファージやT細胞など)が血液脳関門を通過して脳実質に侵入し、組織の損傷につながる可能性があります。
まとめ
PTSDで痛みなどの身体症状がおきる正確なメカニズムはまだ不明ですが、脳の扁桃体が重要な役割を果たしていると考えられます。扁桃体は、感情処理と恐怖条件付けだけでなく、痛みの中枢でもあります。扁桃体の活性化には、サイトカイン、ミクログリア、アストロサイト、末梢免疫細胞等が相互に関わりあっています。扁桃体の活性化は自律神経の異常、視床下部-下垂体-副腎(HPA)軸の異常を引き起こし、さまざまな身体症状を惹起すると考えられます。
参考文献
1】3つの技術でアプローチ! 不定愁訴入門。:西山順滋 (関西医科大学心療内科学講座診療講師/関西医科大学附属病院総合診療科科長)
2】Co-occurrence of severe PTSD, somatic symptoms and dissociation in a large sample of childhood trauma inpatients: a network analysis. European Archives of Psychiatry and Clinical Neuroscience (2022) 272:897-908. https://doi.org/10.1007/s00406-021-01342-z
3】Post-traumatic stress disorder: clinical and translational neuroscience from cells to circuits. Nat Rev Neurol. 2022 May ; 18(5): 273?288. doi:10.1038/s41582-022-00635-8.
4】To Predict, Prevent, and Manage Post-Traumatic Stress Disorder (PTSD): A Review of Pathophysiology, Treatment, and Biomarkers. Int. J. Mol. Sci. 2023, 24, 5238. https://doi.org/10.3390/ijms24065238
5】The Psychedelic Future of Post-Traumatic Stress Disorder Treatment. Current Neuropharmacology, 2024, 22, 636-735
6】Research Progress on Inflammation and Immune Dysregulation in PTSD. Brain and Behavior, 2025; 15:e70633 https://doi.org/10.1002/brb3.70633
7】Innate and adaptive immune system consequences of post-traumatic stress disorder. Auton Neurosci. 2024 April ; 252: 103159. doi:10.1016/j.autneu.2024.103159.
関連ページ
- 複雑性PTSDについて
- 複雑性PTSDについて説明します。
- トラウマと自己免疫疾患
- トラウマと自己免疫疾患について説明します。