関節リウマチの病因(関節外病変)
関節リウマチは主に手足などの関節炎を特徴としますが、関節リウマチ自体は全身性疾患であり、ほぼすべての臓器系に影響を及ぼします。関節外症状は多岐にわたり(無症状の場合もあります)、皮膚や眼の症状、心血管疾患、呼吸器疾患、血液学的異常、リウマチ性血管炎、神経学的症状、アミロイドーシス、肝臓や腎臓の障害などが含まれます。ある研究によると、関節リウマチ患者の約40%に関節外症状が認められると報告されています。いくつかの関節外症状は、疾患の発生時期も異なります。たとえば、間質性肺疾患は、関節リウマチの関節炎の症状が現れる前や、関節リウマチ長期罹患後に現れることがありますが、血管炎、フェルティ症候群、または髄膜炎は、関節リウマチの経過の後期に現れることが多いです。
重要なのは、関節外症状が関節リウマチ患者の生活の質と死亡率に大きく影響するという事です。関節リウマチでは、リウマチ因子(RF)、抗シトルリン化抗体(antibodies to citrullinated protein antigen:ACPA)などの自己抗体が認められますが、RF陽性関節リウマチ患者では、よりびらん性の関節炎にかかりやすくなり、関節外症状、特にリウマチ結節、血管炎、フェルティ症候群、漿膜炎を発症する可能性が高くなります。関節リウマチの関節外症状の病因について、総説(Pathogenesis of Extraarticular Manifestations in Rheumatoid Arthritis?A Comprehensive Review. Biomedicines 2023, 11, 1262. https://doi.org/10.3390/biomedicines11051262)を元にまとめてみました。
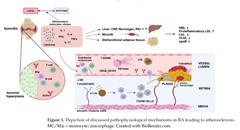
関節リウマチにおける一酸化窒素合成酵素活性の低下のもう1つのメカニズムは、この酵素を競合的に阻害する非対称ジメチルアルギニン (asymmetric dimethylarginine:ADMA) レベルの上昇であると思われます。関節リウマチにおけるADMAレベルの上昇については、いくつかのメカニズムが提案されています。TNF-αや滑膜の低酸素環境によるADMA分解酵素であるジメチルアルギニンジメチルアミノヒドロラーゼ(DDAH) の阻害、関節リウマチ患者の酸化LDLレベルの上昇によって引き起こされる内皮細胞でのタンパク質アルギニンメチルトランスフェラーゼ酵素遺伝子発現の増強によるADMA産生の増強です。
関節リウマチ患者における内皮機能不全の別のメカニズムは、関節リウマチ患者で増加が認められている免疫複合体を含有する微粒子(microparticles)によっても説明可能です。生理学的状態での微粒子は細胞外に存在し、異なる細胞間でタンパク質、核酸、受容体、その他の高分子を運ぶ役目をしています。関節リウマチ患者では、免疫複合体を含有する微粒子が接着分子であるCD54およびCD102の内皮細胞での発現を増加させたり、IL-6、CCL2、CCL5などの炎症性メディエーターの産生を増加させたりして、血管内皮の透過性の増加に寄与すると報告されています。
一方、関節リウマチ患者では「脂質パラドックス」と呼ばれる興味深い現象が報告されています。LDL-Cレベルが低い患者は、中程度のLDL-Cレベルの患者よりも心血管疾患リスクが高くなります。このパラドックスは炎症プロセスに起因する可能性がありますが、まだ完全には解明されていません。L5-LDL画分(LDL-C の最も電気陰性度の高いサブ画分) の増加が関節リウマチ患者の心血管疾患リスクの上昇に関与している可能性もあるかもしれません。ある研究では、関節リウマチ患者ではL5-LDL-C レベルが健常者と比較して有意に高いことが示されました。L5-LDL-C レベルは、無症状の動脈硬化症を伴う関節リウマチ患者でも高く、頸動脈の動脈硬化症の程度と正の相関関係にありました。L5-LDL-C レベルが高いと泡沫細胞の形成が引き起こされ、IL-6、IL-8、TNF-α の発現の増加を引き起こすと報告されています。
「脂質パラドックス」のもう1つの説明は、アテローム性動脈硬化症の保護的役割で知られる高密度リポタンパク質 (high-density lipoprotein:HDL) の機能と構造の異常でも可能となります。炎症状態では、HDLのプロテオームとリピドームが変化し、炎症誘発性HDLの発生につながる可能性があります。炎症誘発性HDLレベルは関節リウマチ患者の疾患活動性と相関していました。炎症誘発性HDLは、通常のHDLとは構造が異なり、アポリポタンパク質A-Iとパラオキソナーゼ1を欠いていますが、酸化リン脂質とリゾリン脂質、遊離コレステロール、遊離脂肪酸、トリアシルグリセロールが豊富に含まれています。さらに、炎症誘発性HDLには、血清アミロイドAやセルロプラスミンなどの炎症誘発性タンパク質が含まれています。炎症誘発性HDLは低密度リポタンパク質(LDL)の酸化を促進し、内皮機能障害を引き起こし、単球の活動を刺激し、炎症誘発性分子の分泌を促進しますが、コレステロール排出活性にはあまり効果がありません。
好中球も動脈硬化性病変で見つかっており、内皮機能障害、単球の動員と活性化、泡沫細胞形成、プラークの不安定化、線維性帽(fibrous cap)の脆弱化に寄与する可能性があることが示唆されています。好中球の抗菌活性の1つである好中球細胞外トラップ(neutrophil extracellular traps:NET)の放出は、健常者と比較して関節リウマチ患者で増加していることが判明し、その放出は疾患活動性、酸化および炎症性血漿マーカーと正の相関関係にありました。NETosis産物(細胞遊離ヌクレオソーム)は、関節リウマチ患者で早期にアテローム性動脈硬化症の有無を特定するための特異的マーカーであることが判明しています。さらに、in vitro試験では、好中球を関節リウマチ患者の血清で処理すると、健常者と比較してNETosisが増加し、それらの培養物の上清は、内皮細胞および末梢血単核細胞における接着分子、血栓促進性、炎症促進性メディエーターに関連する遺伝子の発現を増加させることが示されました。この過程で患者の血清にトシリズマブ、インフリキシマブを添加すると、これらの分子の発現が減少し、関節リウマチ患者の血清中の炎症性サイトカインTNF-αとIL-6がNET媒介炎症およびアテローム血栓形成プロセスに役割を果たしていることを示唆しています。
関節リウマチで重要な役割を果たすことが知られているいくつかのサイトカインも、非虚血性心疾患と関連しています。げっ歯類モデルにおいてTNF-αへの持続的な曝露は、左心室の機能不全、リモデリング、拡張、およびコラーゲン構造の破壊をもたらしました。IL-1は心筋活動を抑制することも示されており、抗IL-1療法は関節リウマチ患者の左心室機能の改善を示しました。さらに、関節リウマチ患者では心筋間質のシトルリン化染色率が高く、ACPAレベルの上昇は左室重量指数の上昇と関連していたため、関節リウマチの特徴であるACPAが心筋機能障害にも役割を果たしている可能性があることが示唆されています。
肺の症状はさまざまな形で現れ、さまざまな肺の区画に影響を及ぼします。肺実質に影響を及ぼす間質性肺疾患、肺結節、塵肺症、胸膜に影響を及ぼす胸水(「4. 膜病変」参照)、または下気道に影響を及ぼす閉塞性/収縮性細気管支炎および気管支拡張症の形で現れます。上気道も影響を受ける可能性があり、輪状披裂炎や血管炎を引き起こし、血管炎や肺高血圧症として現れます。肺実質の結節は、リウマチ結節の形で現れる場合もあれば (「3. リウマチ結節」参照)、シリカ、アスベスト、石炭への職業上の広範な暴露によって起こる炎症性肺疾患である塵肺症によって現れる場合もあります。関節リウマチに伴う塵肺症はカプラン症候群としても知られ、主に患者の肺末梢に多発性結節が発生することを特徴とする稀な疾患です。
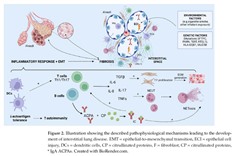
関節リウマチにおける間質性肺疾患は、通常型間質性肺炎 (UIP)および非特異性間質性肺炎(NSIP)のパターンで主に発現するほか、頻度は低いですが、器質化肺炎、リンパ性間質性肺炎、びまん性肺胞障害などのパターンでも発現します。間質性肺疾患の正確な病態生理学的メカニズムは十分に解明されていませんが、複数の要因が関与していると考えられています。関節リウマチと間質性肺疾患が共存する経路として2つが考えられています。1つ目は関節炎から始まり、それが肺に広がり、Th1、Th2、Th17特異的サイトカイン・カスケードなどの炎症反応を引き起こし、その後炎症が肺線維化へと進行し、UIPではない間質性肺炎として現れます。間質性肺疾患発症の2番目に提案されている経路は、遺伝的およびエピジェネティックな因子によって条件付けられた肺胞の微小損傷に対する異常な反応によるもので、これが筋線維芽細胞および上皮細胞の活性化につながり、その結果、炎症が優勢ではない進行性の線維症を引き起こし、特発性肺線維症に似たUIPパターンにつながります。
関節リウマチ-間質性肺疾患の発症には、遺伝的要因と喫煙などの環境要因の両方が関与していると考えられています。HLA-DQB1*03:01、HLADRB1*15、HLA-DRB1*16などのいくつかのHLA遺伝子、およびSFTPC、RTEL1、TERTなどの非HLA遺伝子の変異が関節リウマチ関連肺疾患の素因に関連付けられています。遺伝的に素因のある個人では、喫煙などの抗原刺激を引き起こす気道上皮細胞の繰り返しの損傷により、肺の樹状細胞を介した自己免疫寛容の低下、自己免疫の活性化を引き起こし、自己抗体の産生とT細胞の活性化を引き起こします。血清中のACPAレベルが高いと気道疾患および間質性肺疾患と相関することが示されています。ACPAは免疫複合体を形成し、IL-6、IL-8、TNF などの炎症性サイトカインの放出を引き起こして細胞傷害に寄与する可能性があり、NETの放出も引き起こす可能性があります。関節リウマチ-間質性肺疾患に寄与するその他のメカニズムには、線維芽細胞の増殖と細胞外マトリックスの生成、続いて線維症につながるサイトカインIL-17AとTGF-β1を含むTh17細胞介在性免疫が含まれます。
特に、喫煙は関節リウマチ関連肺疾患の発症に重要な要因であり、タバコの煙の成分が 関節リウマチの発症に関連していることがわかっています。多環芳香族炭化水素は特に興味深いようで、滑膜樹状細胞内の特定の転写因子(芳香族炭化水素受容体)を活性化し、IL-6の産生を増加させることが示されています。ニコチンも間質性肺疾患の発症に重要な役割を果たしているようで、ACPAの供給源であるNETの放出を誘導し、滑膜細胞によるサイトカインの活性化と放出を促進することが示されています。さらに、喫煙者は間質組織と気道組織中の樹状細胞数が増加していることが示されています。
また、腸内細菌叢の乱れなど、自己免疫を増強する他の原因と関節リウマチ関連肺疾患との関連も見つかっています。さらに、胃食道逆流症は、腸内細菌叢の乱れに影響を及ぼし、気道への原因病原体の導入を媒介する可能性があります。これらの遺伝的要因と環境因子が組み合わさって炎症反応が起こり、上皮間葉転換とともに間質の線維化とリモデリングが起こり、最終的に間質性肺疾患が発生します。
関節リウマチ関連気管支拡張症の病因はまだ十分に解明されていませんが、粘液繊毛クリアランスの低下、慢性感染、持続性炎症反応、および異常な気道リモデリングが、気管支拡張症発症の主な原因であると考えられています。すなわち、感染によって引き起こされる広範な肺の炎症が呼吸器上皮の損傷、粘液繊毛装置の阻害、およびそれに続く細菌の過剰増殖につながる可能性があるとされています。結果として生じる持続感染は炎症を永続させ、続いてサイトカインとプロテアーゼの産生が呼吸器上皮をさらに損傷し、感染、炎症、および気道損傷の悪循環を引き起こします。増悪を伴う気管支拡張症患者ではIL-17a、IL-1、IL-8の濃度上昇が報告されています。
さらに、関節リウマチではない気管支拡張症患者は健常者と比較して血清ACPAが上昇していることが示されており、反復性感染症だけでもACPA生成に十分である可能性を示唆しています。さらに、ACPA陽性レベルは高解像度CT撮影で確認された気管支拡張の程度と気道肥厚に関連していることが報告されています。
リウマチ結節の最初のプロセスは小血管の内皮損傷です。内皮損傷によりRF複合体の凝集と単球およびマクロファージの活性化を招き、IL-1、プロスタグランジンE2、TNF、TGF、ならびにプロテアーゼ、コラーゲナーゼ、および走化性因子が単球やマクロファージから分泌されます。これに続いてフィブリン沈着、細胞溶解性および酵素分解が起こり、壊死を引き起こします。リウマチ結節ではIL-1、IL-10、IL-12、IL-15、IL-18が高レベルに検出されています。これらの結果は、関節リウマチ滑膜病変と同じサイトカインプロファイル(Th1誘導性炎症プロセスに起因する)がリウマチ結節に存在することを示しています。
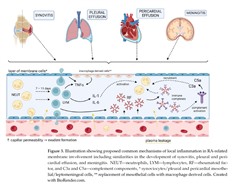
リウマチ性胸水は通常は滲出性で、グルコース・補体は低値で、タンパク質は高値であり、RFおよび免疫複合体を含みます。リウマチ性胸水で見つかる細胞は、最初の数日間は主に好中球であり、7~11日後にはリンパ球に置き換わります。オタマジャクシ細胞および多核巨細胞、ならびに壁側胸膜中皮細胞が柵状のマクロファージ由来細胞に置き換わる現象は、疾患の特徴と考えられており、関節リウマチの滑膜組織学的所見と類似しています。興味深い事に胸膜組織と心膜組織の両方でRFと免疫複合体が血清中よりも高いレベルで検出されることが示されており、これは血清中の免疫複合体の沈着ではなく、膜内の局所的な体液性免疫応答(免疫複合体の合成)を示唆しています。高 TNF-α と低インターフェロンというサイトカインプロファイルや代替補体経路と古典的補体経路の両方の活性化や免疫複合体の増加は、関節リウマチにおける滑膜と漿膜の局所炎症の病因が類似していることを示唆しています。リウマチ性心膜液中のサイトカイン濃度に関する系統的な研究は見つかっていませんが、リウマチ性心膜液中のIL-6濃度が高い症例報告や、関節リウマチに伴う滲出性収縮性心膜炎を抗IL-1薬で治療し成功した症例があり、これらのサイトカインが漿膜炎に関与していることを示唆しています。一方、関節リウマチ患者における炎症だけでなく、アルブミン値の低下による膠質浸透圧の低下もリウマチ性心嚢液貯留に関連する重要な変数であることが判明しています。
リウマチ性髄膜炎は非常にまれであるため、その病因に関する情報は少なく、主に症例報告に依存しています。患者の約半数は関節疾患活動性が低い状態でリウマチ性髄膜炎を発症します。リウマチ性髄膜炎は、通常は関節リウマチの長い(10年以上)病歴を持つ患者に現れることが多く見られます。リウマチ性髄膜炎の特徴的な組織病理学的所見は、硬膜炎または軟膜炎、リウマチ結節、および血管炎です。髄膜炎は通常、単核細胞、特に形質細胞の非特異的浸潤からなり、場合によっては、多核巨細胞が見つかることもあります。脳脊髄液分析では特異的な所見は得られず、通常は軽度のリンパ球増多、タンパク質レベルの上昇、正常から低グルコースレベルが認められますが、RF上昇の所見は一貫していません。サイトカインに関しては、重度のリウマチ性髄膜炎患者の脳脊髄液中のIL-6の上昇を発見されています。
関節リウマチの関節炎の結果であるこれらの神経学的症状とは対照的に、リウマチ性髄膜炎(「4. 膜病変」参照)と虚血性神経障害は、関節外炎症によって引き起こされます。リウマチ性血管炎による虚血性神経障害は、通常、単神経炎、多発性単神経炎、多巣性感覚運動神経障害、および遠位対称性感覚神経障害として現れます(「9. リウマチ性血管炎」参照)。
上強膜炎は、上強膜組織の表層血管の非肉芽腫性炎症の結果であり、その結果、血管拡張および血管周囲浸潤が生じると仮定されています。直接的な実験データは提供されていませんが、眼の組織損傷を誘発する疾患メディエーター(IL-2、IL-6、IL-8、MMP、NO、TNF、およびTGF-βなど)が関与している可能性があります。上強膜炎は結膜と強膜の間の薄い組織の層の炎症を指すのに対し、強膜炎は強膜全体に影響を及ぼすより重篤な状態です。関節炎マウスモデルの研究で、マクロファージ、形質細胞、免疫複合体の沈着、および血管とリンパ管の増殖が関節リウマチ強膜炎の発症に役割を果たしている可能性があることが示されました。
周辺性潰瘍性角膜炎の病因はCD4+ T細胞の活性化と関連しており、抗体産生と免疫複合体沈着ならびに補体活性化を引き起こし、その結果MMPを産生する好中球とマクロファージが蓄積すると考えられています。
関節リウマチにおける慢性疾患の貧血は、サイトカインを介した鉄利用の阻害、赤血球前駆細胞のアポトーシス、エリスロポエチン産生の阻害などの複数の病態生理学的メカニズムによって生じると考えられています。貧血を合併する関節リウマチ患者は非貧血患者と比較して血清中のTNF、IL-1、IL-6のレベルが有意に高く、これらのサイトカインが骨髄培養に対して阻害効果を持つことを示されています。関節リウマチでは非ステロイド性抗炎症薬の長期使用の結果として消化管出血を引き起こし、鉄欠乏性貧血を呈する事があります。また、慢性疾患の貧血では、ヘプシジン(主要な鉄調節ホルモン)の過剰発現により鉄が循環せずに貯蔵され、鉄制限性赤血球産生につながるため、機能性鉄欠乏症も起こる可能性があります。
RANKL(receptor activator of nuclear factor kappa-B ligand)は、骨組織の分解を担う破骨細胞の形成と活性化に重要な役割を果たすタンパク質です。関節リウマチ患者を対象に実施された研究では、老化したCD4+細胞は高いレベルのRANKLを産生することが示されました。関節リウマチ患者ではCD4+ T helper17(TH17)細胞も、破骨細胞形成のプロセスを誘発します。Th17細胞はRANKLとIL-17という2つの必須因子を生成し、IL-17は線維芽細胞と骨芽細胞によるRANKLの産生を刺激します。さらに、Th17細胞は骨芽細胞と間質細胞によるマクロファージコロニー刺激因子とRANKLの産生を促進し、破骨細胞におけるTNFとRANKの発現も誘導します。
ACPAは関節リウマチにおける骨量減少の媒介に役割を果たしていると考えられています。ACPA陽性関節リウマチの人はACPA陰性の人に比べて骨密度が有意に低いことがわかっています。ACPAは、破骨細胞の表面にあるシトルリン化ビメンチンに結合してこれらの骨吸収細胞の分化と活性化を促進し、全身の骨量減少に寄与する可能性があります。
関節リウマチにおける全身の骨密度低下は、慢性炎症、グルココルチコイドの使用、ビタミンD欠乏症、閉経(女性ホルモン低下)、身体活動の低下(サルコペニア)など、さまざまな要因が組み合わさって起こると考えられています。メタ分析の結果、関節リウマチにおけるグルココルチコイドは、特に高用量の場合、骨粗鬆症のリスクを高める可能性があることが示されました。
特定のHLA-DRB1 SE遺伝子型(0401/*0401、*0401/*0404、*0101/*0401など)はリウマチ性血管炎に関連していることが示されています。喫煙はリウマチ性血管炎の危険因子で、内皮機能不全、血管閉塞につながる可能性があります。リウマチ性血管炎患者の補体レベルが低いことから、血液中のRF免疫複合体がC3に結合し、血管壁への免疫複合体の沈着と補体の活性化が炎症と破壊につながることが示唆されます。
関節リウマチ患者の腎生検で最も一般的な組織学的所見は、メサンギウム糸球体腎炎、膜性腎症、および二次性アミロイドーシスです。関節リウマチ患者のIL-6レベルが高いことも、メサンギウム糸球体腎炎の病態に関与している可能性があります。関節リウマチ患者の膜性腎症は、ブシラミン、D-ペニシラミン、金などの特定のDMARDに関連しており、特定の関節リウマチ関連メカニズムによって直接引き起こされるのではないことを示唆しています。対照的に、二次性アミロイドーシスは、制御されていない関節リウマチ活動によって引き起こされ、肝細胞による血清アミロイドA産生を引き起こす炎症性サイトカインの高レベルにつながります。その後、血清アミロイドAが腎臓に沈着し、特に遺伝的に素因のある人で腎臓機能障害を引き起こします。
https://doi.org/10.3390/biomedicines11051262
<<2024年7月17日作成>>
重要なのは、関節外症状が関節リウマチ患者の生活の質と死亡率に大きく影響するという事です。関節リウマチでは、リウマチ因子(RF)、抗シトルリン化抗体(antibodies to citrullinated protein antigen:ACPA)などの自己抗体が認められますが、RF陽性関節リウマチ患者では、よりびらん性の関節炎にかかりやすくなり、関節外症状、特にリウマチ結節、血管炎、フェルティ症候群、漿膜炎を発症する可能性が高くなります。関節リウマチの関節外症状の病因について、総説(Pathogenesis of Extraarticular Manifestations in Rheumatoid Arthritis?A Comprehensive Review. Biomedicines 2023, 11, 1262. https://doi.org/10.3390/biomedicines11051262)を元にまとめてみました。
1. 心血管疾患
関節リウマチ患者では、冠動脈疾患、心不全、脳卒中の発生率が高いことを示す証拠が数多くあります。欧米では、心血管疾患は、関節リウマチ患者の死亡原因の第1位です(日本では肺炎などの感染症が第1位)。メタ分析では、関節リウマチ患者は一般集団と比較して心血管疾患の発症リスクが48%増加し、心血管疾患による死亡率は約52%増加することが示されています。関節リウマチの関節外症状としての心血管疾患(アテローム性動脈硬化症、非虚血性心疾患)についてまとめます。
1.1. アテローム性動脈硬化症
今日では、血管壁への脂質蓄積に加えて炎症が動脈硬化の発症に重要な役割を果たしていることが知られています。関節リウマチでは脂質代謝異常に加えて、全身性炎症が、動脈硬化の進展に寄与しています。1.1.1. 血管内皮機能障害
血管内皮機能障害は動脈硬化の第一段階であり、関節リウマチでは、全身性炎症、炎症性サイトカイン(TNF-α、IL-6、IL-1、IFN-γ、IL-17)、酸化ストレス、特定のホルモン(レプチン、レジスチン、アディポネクチン)の不均衡、接着分子の発現増加、内皮前駆細胞機能の変化、免疫調節異常、遺伝的素因など、複数の要因が血管内皮機能障害と関連しています。全身性炎症と免疫調節異常は、動脈で重要な保護的役割を果たす分子である一酸化窒素(NO)の産生を阻害すると思われます。関節リウマチの発症に重要なサイトカインであるTNF-αは、内皮型一酸化窒素合成酵素プロモーター活性を阻害し、内皮中のNOレベルを低下させることが示されています。関節リウマチにおける一酸化窒素合成酵素活性の低下のもう1つのメカニズムは、この酵素を競合的に阻害する非対称ジメチルアルギニン (asymmetric dimethylarginine:ADMA) レベルの上昇であると思われます。関節リウマチにおけるADMAレベルの上昇については、いくつかのメカニズムが提案されています。TNF-αや滑膜の低酸素環境によるADMA分解酵素であるジメチルアルギニンジメチルアミノヒドロラーゼ(DDAH) の阻害、関節リウマチ患者の酸化LDLレベルの上昇によって引き起こされる内皮細胞でのタンパク質アルギニンメチルトランスフェラーゼ酵素遺伝子発現の増強によるADMA産生の増強です。
関節リウマチ患者における内皮機能不全の別のメカニズムは、関節リウマチ患者で増加が認められている免疫複合体を含有する微粒子(microparticles)によっても説明可能です。生理学的状態での微粒子は細胞外に存在し、異なる細胞間でタンパク質、核酸、受容体、その他の高分子を運ぶ役目をしています。関節リウマチ患者では、免疫複合体を含有する微粒子が接着分子であるCD54およびCD102の内皮細胞での発現を増加させたり、IL-6、CCL2、CCL5などの炎症性メディエーターの産生を増加させたりして、血管内皮の透過性の増加に寄与すると報告されています。
1.1.2. リポ蛋白質の異常
血管内膜に低密度リポタンパク質コレステロール(Low-density lipoprotein cholesterol:LDL-C)が沈着し、LDL-Cが酸化されることは、アテローム性動脈硬化症の重要なステップです。関節リウマチ患者では、LDL-C高値を伴う脂質異常症やインスリン抵抗性の有病率の増加が観察されています。一方、関節リウマチ患者では「脂質パラドックス」と呼ばれる興味深い現象が報告されています。LDL-Cレベルが低い患者は、中程度のLDL-Cレベルの患者よりも心血管疾患リスクが高くなります。このパラドックスは炎症プロセスに起因する可能性がありますが、まだ完全には解明されていません。L5-LDL画分(LDL-C の最も電気陰性度の高いサブ画分) の増加が関節リウマチ患者の心血管疾患リスクの上昇に関与している可能性もあるかもしれません。ある研究では、関節リウマチ患者ではL5-LDL-C レベルが健常者と比較して有意に高いことが示されました。L5-LDL-C レベルは、無症状の動脈硬化症を伴う関節リウマチ患者でも高く、頸動脈の動脈硬化症の程度と正の相関関係にありました。L5-LDL-C レベルが高いと泡沫細胞の形成が引き起こされ、IL-6、IL-8、TNF-α の発現の増加を引き起こすと報告されています。
「脂質パラドックス」のもう1つの説明は、アテローム性動脈硬化症の保護的役割で知られる高密度リポタンパク質 (high-density lipoprotein:HDL) の機能と構造の異常でも可能となります。炎症状態では、HDLのプロテオームとリピドームが変化し、炎症誘発性HDLの発生につながる可能性があります。炎症誘発性HDLレベルは関節リウマチ患者の疾患活動性と相関していました。炎症誘発性HDLは、通常のHDLとは構造が異なり、アポリポタンパク質A-Iとパラオキソナーゼ1を欠いていますが、酸化リン脂質とリゾリン脂質、遊離コレステロール、遊離脂肪酸、トリアシルグリセロールが豊富に含まれています。さらに、炎症誘発性HDLには、血清アミロイドAやセルロプラスミンなどの炎症誘発性タンパク質が含まれています。炎症誘発性HDLは低密度リポタンパク質(LDL)の酸化を促進し、内皮機能障害を引き起こし、単球の活動を刺激し、炎症誘発性分子の分泌を促進しますが、コレステロール排出活性にはあまり効果がありません。
1.1.3. 免疫細胞の役割
血管内皮が機能不全になった後に単球が集積することは、アテローム形成の重要なステップです。しかし、単球/マクロファージだけでなく、好中球、Tリンパ球、Bリンパ球もすべてアテローム性動脈硬化症に関与していると思われます。アテローム性動脈硬化性プラークに移動した単球は、LDLを取り込んで泡沫細胞を形成するマクロファージに分化することが、アテローム性動脈硬化症でよく知られています。研究によると、CD14+、CD16+ 単球の割合の増加は、より重篤な冠動脈疾患と関連していて、関節リウマチ患者で増加しています。さらに、関節リウマチ患者の血清中で増加しているIL-6によって単球の血管内皮への凝集活性が増強され(プラークへの単球の動員増強)、血栓イベントのリスク増加につながることがわかりました。好中球も動脈硬化性病変で見つかっており、内皮機能障害、単球の動員と活性化、泡沫細胞形成、プラークの不安定化、線維性帽(fibrous cap)の脆弱化に寄与する可能性があることが示唆されています。好中球の抗菌活性の1つである好中球細胞外トラップ(neutrophil extracellular traps:NET)の放出は、健常者と比較して関節リウマチ患者で増加していることが判明し、その放出は疾患活動性、酸化および炎症性血漿マーカーと正の相関関係にありました。NETosis産物(細胞遊離ヌクレオソーム)は、関節リウマチ患者で早期にアテローム性動脈硬化症の有無を特定するための特異的マーカーであることが判明しています。さらに、in vitro試験では、好中球を関節リウマチ患者の血清で処理すると、健常者と比較してNETosisが増加し、それらの培養物の上清は、内皮細胞および末梢血単核細胞における接着分子、血栓促進性、炎症促進性メディエーターに関連する遺伝子の発現を増加させることが示されました。この過程で患者の血清にトシリズマブ、インフリキシマブを添加すると、これらの分子の発現が減少し、関節リウマチ患者の血清中の炎症性サイトカインTNF-αとIL-6がNET媒介炎症およびアテローム血栓形成プロセスに役割を果たしていることを示唆しています。
1.2. 非虚血性心疾患
関節リウマチ患者は心不全のリスクが高いが、これは虚血性心疾患のリスク増加だけでは十分に説明できません。関節リウマチの疾患活動性が高いことはすべてのタイプの心不全と関連していましたが、関節リウマチ患者で非虚血性心疾患リスクが高い理由は十分には解明されていません。磁気共鳴画像法(MRI)や陽電子放出断層撮影法(PET)/コンピューター断層撮影法(CT)などの放射線学的画像診断では、関節リウマチの疾患活動性が心筋の炎症および線維化の増加と関連していることが示されており、関節リウマチの特徴である全身性炎症が心室の硬化、ひいては収縮期および拡張機能障害につながる可能性があることを示唆しています。関節リウマチで重要な役割を果たすことが知られているいくつかのサイトカインも、非虚血性心疾患と関連しています。げっ歯類モデルにおいてTNF-αへの持続的な曝露は、左心室の機能不全、リモデリング、拡張、およびコラーゲン構造の破壊をもたらしました。IL-1は心筋活動を抑制することも示されており、抗IL-1療法は関節リウマチ患者の左心室機能の改善を示しました。さらに、関節リウマチ患者では心筋間質のシトルリン化染色率が高く、ACPAレベルの上昇は左室重量指数の上昇と関連していたため、関節リウマチの特徴であるACPAが心筋機能障害にも役割を果たしている可能性があることが示唆されています。
2. 呼吸器合併症
関節リウマチの肺症状は最も一般的な関節外症状の1つであり、その発生率は10%から67%と報告されています。肺症状は通常、関節症状の後に発生しますが、肺疾患は関節リウマチの関節炎などの典型的な症状よりも何年も前に発生することもあります。咳や息切れを伴う症状のある上気道または下気道疾患は、関節リウマチ患者の30%で報告されています。肺の症状はさまざまな形で現れ、さまざまな肺の区画に影響を及ぼします。肺実質に影響を及ぼす間質性肺疾患、肺結節、塵肺症、胸膜に影響を及ぼす胸水(「4. 膜病変」参照)、または下気道に影響を及ぼす閉塞性/収縮性細気管支炎および気管支拡張症の形で現れます。上気道も影響を受ける可能性があり、輪状披裂炎や血管炎を引き起こし、血管炎や肺高血圧症として現れます。肺実質の結節は、リウマチ結節の形で現れる場合もあれば (「3. リウマチ結節」参照)、シリカ、アスベスト、石炭への職業上の広範な暴露によって起こる炎症性肺疾患である塵肺症によって現れる場合もあります。関節リウマチに伴う塵肺症はカプラン症候群としても知られ、主に患者の肺末梢に多発性結節が発生することを特徴とする稀な疾患です。

2.1. 間質性肺疾患
間質性肺疾患は関節リウマチの肺症状の中で最も一般的で、関節リウマチ患者の30~60%でその兆候が報告されています。しかし、間質性肺疾患は一般的に無症状であり、ある研究では、間質性肺疾患合併関節リウマチ患者の76%に明らかな症状が見られなかったことが示されています。他の報告では、症状のある間質性肺疾患は 関節リウマチ患者の5~17%に発生すると報告されています。関節リウマチにおける間質性肺疾患は、通常型間質性肺炎 (UIP)および非特異性間質性肺炎(NSIP)のパターンで主に発現するほか、頻度は低いですが、器質化肺炎、リンパ性間質性肺炎、びまん性肺胞障害などのパターンでも発現します。間質性肺疾患の正確な病態生理学的メカニズムは十分に解明されていませんが、複数の要因が関与していると考えられています。関節リウマチと間質性肺疾患が共存する経路として2つが考えられています。1つ目は関節炎から始まり、それが肺に広がり、Th1、Th2、Th17特異的サイトカイン・カスケードなどの炎症反応を引き起こし、その後炎症が肺線維化へと進行し、UIPではない間質性肺炎として現れます。間質性肺疾患発症の2番目に提案されている経路は、遺伝的およびエピジェネティックな因子によって条件付けられた肺胞の微小損傷に対する異常な反応によるもので、これが筋線維芽細胞および上皮細胞の活性化につながり、その結果、炎症が優勢ではない進行性の線維症を引き起こし、特発性肺線維症に似たUIPパターンにつながります。
関節リウマチ-間質性肺疾患の発症には、遺伝的要因と喫煙などの環境要因の両方が関与していると考えられています。HLA-DQB1*03:01、HLADRB1*15、HLA-DRB1*16などのいくつかのHLA遺伝子、およびSFTPC、RTEL1、TERTなどの非HLA遺伝子の変異が関節リウマチ関連肺疾患の素因に関連付けられています。遺伝的に素因のある個人では、喫煙などの抗原刺激を引き起こす気道上皮細胞の繰り返しの損傷により、肺の樹状細胞を介した自己免疫寛容の低下、自己免疫の活性化を引き起こし、自己抗体の産生とT細胞の活性化を引き起こします。血清中のACPAレベルが高いと気道疾患および間質性肺疾患と相関することが示されています。ACPAは免疫複合体を形成し、IL-6、IL-8、TNF などの炎症性サイトカインの放出を引き起こして細胞傷害に寄与する可能性があり、NETの放出も引き起こす可能性があります。関節リウマチ-間質性肺疾患に寄与するその他のメカニズムには、線維芽細胞の増殖と細胞外マトリックスの生成、続いて線維症につながるサイトカインIL-17AとTGF-β1を含むTh17細胞介在性免疫が含まれます。
特に、喫煙は関節リウマチ関連肺疾患の発症に重要な要因であり、タバコの煙の成分が 関節リウマチの発症に関連していることがわかっています。多環芳香族炭化水素は特に興味深いようで、滑膜樹状細胞内の特定の転写因子(芳香族炭化水素受容体)を活性化し、IL-6の産生を増加させることが示されています。ニコチンも間質性肺疾患の発症に重要な役割を果たしているようで、ACPAの供給源であるNETの放出を誘導し、滑膜細胞によるサイトカインの活性化と放出を促進することが示されています。さらに、喫煙者は間質組織と気道組織中の樹状細胞数が増加していることが示されています。
また、腸内細菌叢の乱れなど、自己免疫を増強する他の原因と関節リウマチ関連肺疾患との関連も見つかっています。さらに、胃食道逆流症は、腸内細菌叢の乱れに影響を及ぼし、気道への原因病原体の導入を媒介する可能性があります。これらの遺伝的要因と環境因子が組み合わさって炎症反応が起こり、上皮間葉転換とともに間質の線維化とリモデリングが起こり、最終的に間質性肺疾患が発生します。
2.2. 気管支拡張症
レントゲン画像や肺機能検査によって気管支拡張症は関節リウマチ患者の30%に発見されています。しかし、必ずしも臨床症状を伴うわけではありません。間質性肺疾患によって、肺組織の牽引を引き起こして気管支拡張症を発症させる可能性があります。ただし、気管支拡張症は、間質性肺疾患なしに独立して発症することもあります。関節リウマチ関連気管支拡張症の病因はまだ十分に解明されていませんが、粘液繊毛クリアランスの低下、慢性感染、持続性炎症反応、および異常な気道リモデリングが、気管支拡張症発症の主な原因であると考えられています。すなわち、感染によって引き起こされる広範な肺の炎症が呼吸器上皮の損傷、粘液繊毛装置の阻害、およびそれに続く細菌の過剰増殖につながる可能性があるとされています。結果として生じる持続感染は炎症を永続させ、続いてサイトカインとプロテアーゼの産生が呼吸器上皮をさらに損傷し、感染、炎症、および気道損傷の悪循環を引き起こします。増悪を伴う気管支拡張症患者ではIL-17a、IL-1、IL-8の濃度上昇が報告されています。
さらに、関節リウマチではない気管支拡張症患者は健常者と比較して血清ACPAが上昇していることが示されており、反復性感染症だけでもACPA生成に十分である可能性を示唆しています。さらに、ACPA陽性レベルは高解像度CT撮影で確認された気管支拡張の程度と気道肥厚に関連していることが報告されています。
3. リウマチ結節
通常、リウマチ結節は伸筋表面または繰り返し圧迫や外傷を受けた皮膚に現れます。リウマチ結節は皮膚以外の場所に現れることもあり、最も一般的には肺に現れます。肺リウマチ結節の関節リウマチ患者での有病率は0.4~32%と報告されており、ほとんどが無症状であると考えられています。組織学的には、リウマチ結節は、マクロファージ、リンパ球、組織球に囲まれた中心壊死を伴う免疫介在性肉芽腫に相当します。病因に関与すると考えられる一般的なメカニズムは、局所損傷、小毛細血管炎、免疫複合体およびタンパク質分解酵素の影響です。結節周囲の血管、または中心部の壊死血管に急性血管炎が見られることもまれにあります。リウマチ結節の最初のプロセスは小血管の内皮損傷です。内皮損傷によりRF複合体の凝集と単球およびマクロファージの活性化を招き、IL-1、プロスタグランジンE2、TNF、TGF、ならびにプロテアーゼ、コラーゲナーゼ、および走化性因子が単球やマクロファージから分泌されます。これに続いてフィブリン沈着、細胞溶解性および酵素分解が起こり、壊死を引き起こします。リウマチ結節ではIL-1、IL-10、IL-12、IL-15、IL-18が高レベルに検出されています。これらの結果は、関節リウマチ滑膜病変と同じサイトカインプロファイル(Th1誘導性炎症プロセスに起因する)がリウマチ結節に存在することを示しています。
4. 膜病変
関節リウマチの関節外症状の一部として、胸膜、心膜、および髄膜が影響を受ける可能性があります。胸水と心膜液はそれぞれ関節リウマチ患者の70%と30~50%に見られますが、症候性の胸膜炎と心膜炎は、それぞれ患者の3~5%と10%未満にしか見られません。また、胸水、心膜液、およびリウマチ性髄膜炎は、RFの高力価に関連しています。関節リウマチの膜病変の炎症プロセスと、滑膜の炎症プロセスとの間に類似点があることは注目に値します。
リウマチ性胸水は通常は滲出性で、グルコース・補体は低値で、タンパク質は高値であり、RFおよび免疫複合体を含みます。リウマチ性胸水で見つかる細胞は、最初の数日間は主に好中球であり、7~11日後にはリンパ球に置き換わります。オタマジャクシ細胞および多核巨細胞、ならびに壁側胸膜中皮細胞が柵状のマクロファージ由来細胞に置き換わる現象は、疾患の特徴と考えられており、関節リウマチの滑膜組織学的所見と類似しています。興味深い事に胸膜組織と心膜組織の両方でRFと免疫複合体が血清中よりも高いレベルで検出されることが示されており、これは血清中の免疫複合体の沈着ではなく、膜内の局所的な体液性免疫応答(免疫複合体の合成)を示唆しています。高 TNF-α と低インターフェロンというサイトカインプロファイルや代替補体経路と古典的補体経路の両方の活性化や免疫複合体の増加は、関節リウマチにおける滑膜と漿膜の局所炎症の病因が類似していることを示唆しています。リウマチ性心膜液中のサイトカイン濃度に関する系統的な研究は見つかっていませんが、リウマチ性心膜液中のIL-6濃度が高い症例報告や、関節リウマチに伴う滲出性収縮性心膜炎を抗IL-1薬で治療し成功した症例があり、これらのサイトカインが漿膜炎に関与していることを示唆しています。一方、関節リウマチ患者における炎症だけでなく、アルブミン値の低下による膠質浸透圧の低下もリウマチ性心嚢液貯留に関連する重要な変数であることが判明しています。
リウマチ性髄膜炎は非常にまれであるため、その病因に関する情報は少なく、主に症例報告に依存しています。患者の約半数は関節疾患活動性が低い状態でリウマチ性髄膜炎を発症します。リウマチ性髄膜炎は、通常は関節リウマチの長い(10年以上)病歴を持つ患者に現れることが多く見られます。リウマチ性髄膜炎の特徴的な組織病理学的所見は、硬膜炎または軟膜炎、リウマチ結節、および血管炎です。髄膜炎は通常、単核細胞、特に形質細胞の非特異的浸潤からなり、場合によっては、多核巨細胞が見つかることもあります。脳脊髄液分析では特異的な所見は得られず、通常は軽度のリンパ球増多、タンパク質レベルの上昇、正常から低グルコースレベルが認められますが、RF上昇の所見は一貫していません。サイトカインに関しては、重度のリウマチ性髄膜炎患者の脳脊髄液中のIL-6の上昇を発見されています。
5. 神経系障害
関節リウマチにおける神経系の障害には、絞扼性神経障害、リウマチ性血管炎による虚血性神経障害、頚椎障害(環軸椎亜脱臼、脳底陥入)、リウマチ性髄膜炎、まれに血管炎やアミロイドーシスなどがあります。頚椎障害による神経症状は、環軸椎後頭関節と環軸椎関節の炎症の結果であり、パンヌス形成と関節近傍骨の侵食を招き、罹患関節による脊髄、神経根、脳神経、髄質、または椎骨動脈の圧迫を引き起こす可能性があります。同様に、圧迫性末梢神経障害は、末梢神経(最も多くは正中神経で、手根管症候群の原因となる)の圧迫、腱鞘炎による隣接腱の腫脹、または関節滑膜の炎症によって引き起こされます。関節リウマチの関節炎の結果であるこれらの神経学的症状とは対照的に、リウマチ性髄膜炎(「4. 膜病変」参照)と虚血性神経障害は、関節外炎症によって引き起こされます。リウマチ性血管炎による虚血性神経障害は、通常、単神経炎、多発性単神経炎、多巣性感覚運動神経障害、および遠位対称性感覚神経障害として現れます(「9. リウマチ性血管炎」参照)。
6. 眼病変
関節リウマチ患者の約18%に眼への影響が認められます。乾性角結膜炎、上強膜炎、強膜炎、周辺性潰瘍性角膜炎、前部ぶどう膜炎などが認められます。乾性角結膜炎を伴う関節リウマチ患者の涙液中のサイトカインのレベルを比較した結果、IL-1および IL-6の減少、IL-17 の上昇が認められました。上強膜炎は、上強膜組織の表層血管の非肉芽腫性炎症の結果であり、その結果、血管拡張および血管周囲浸潤が生じると仮定されています。直接的な実験データは提供されていませんが、眼の組織損傷を誘発する疾患メディエーター(IL-2、IL-6、IL-8、MMP、NO、TNF、およびTGF-βなど)が関与している可能性があります。上強膜炎は結膜と強膜の間の薄い組織の層の炎症を指すのに対し、強膜炎は強膜全体に影響を及ぼすより重篤な状態です。関節炎マウスモデルの研究で、マクロファージ、形質細胞、免疫複合体の沈着、および血管とリンパ管の増殖が関節リウマチ強膜炎の発症に役割を果たしている可能性があることが示されました。
周辺性潰瘍性角膜炎の病因はCD4+ T細胞の活性化と関連しており、抗体産生と免疫複合体沈着ならびに補体活性化を引き起こし、その結果MMPを産生する好中球とマクロファージが蓄積すると考えられています。
7. 血液学的異常
関節リウマチでは、貧血、好中球減少症(特にフェルティ症候群)、血小板減少症、血小板増多症、好酸球増多症、造血悪性腫瘍など、さまざまな血液学的異常が現れることがあります。活動性疾患ではリンパ節腫脹も見られ、病理組織学的には良性濾胞性過形成を呈します。貧血と血小板増多症はどちらも疾患活動性と相関関係にあります。IL-6は血小板増多に関与しています。関節リウマチにおける慢性疾患の貧血は、サイトカインを介した鉄利用の阻害、赤血球前駆細胞のアポトーシス、エリスロポエチン産生の阻害などの複数の病態生理学的メカニズムによって生じると考えられています。貧血を合併する関節リウマチ患者は非貧血患者と比較して血清中のTNF、IL-1、IL-6のレベルが有意に高く、これらのサイトカインが骨髄培養に対して阻害効果を持つことを示されています。関節リウマチでは非ステロイド性抗炎症薬の長期使用の結果として消化管出血を引き起こし、鉄欠乏性貧血を呈する事があります。また、慢性疾患の貧血では、ヘプシジン(主要な鉄調節ホルモン)の過剰発現により鉄が循環せずに貯蔵され、鉄制限性赤血球産生につながるため、機能性鉄欠乏症も起こる可能性があります。
7.1. Felty Syndrome(フェルティ症候群)
関節リウマチにおける好中球減少症は、主に関節リウマチに特有の疾患であるフェルティ症候群の一部としてよく議論されております。フェルティ症候群は、血清反応陽性関節リウマチのまれな関節外症状で、好中球減少症と脾腫を特徴とし、特に皮膚と呼吸器系の重度かつ再発性の感染症を引き起こします。通常、関節リウマチの長期罹患後に発症します。フェルティ症候群の特徴的な症状である好??中球減少症の原因については、骨髄での顆粒球形成の阻害、G-CSF誘導性成熟の低下、末梢好中球の破壊、脾臓での好中球の隔離など、いくつかのメカニズムが報告されています。8. 骨粗鬆症
骨粗鬆症は関節リウマチにおける免疫細胞と骨リモデリングを担う細胞との複雑な相互作用が関与していることが明らかになっています。関節リウマチは、罹患関節局所、関節近傍、全身のいずれにおいても骨量減少を引き起こす可能性があります。関節リウマチにおける全身性および局所性骨量減少の病因は同様です。関節リウマチにおける局所性骨量減少(びらんなど)は、滑膜組織で起こる炎症プロセスの結果であり、骨組織を分解する細胞である破骨細胞による骨吸収によります。TNF、IL-6、IL-17などの炎症性分子は骨組織の破壊を促進する可能性があり、骨粗鬆症のある関節リウマチ患者では、骨粗鬆症のない患者と比較してそれらのレベルが高いことがわかっています。RANKL(receptor activator of nuclear factor kappa-B ligand)は、骨組織の分解を担う破骨細胞の形成と活性化に重要な役割を果たすタンパク質です。関節リウマチ患者を対象に実施された研究では、老化したCD4+細胞は高いレベルのRANKLを産生することが示されました。関節リウマチ患者ではCD4+ T helper17(TH17)細胞も、破骨細胞形成のプロセスを誘発します。Th17細胞はRANKLとIL-17という2つの必須因子を生成し、IL-17は線維芽細胞と骨芽細胞によるRANKLの産生を刺激します。さらに、Th17細胞は骨芽細胞と間質細胞によるマクロファージコロニー刺激因子とRANKLの産生を促進し、破骨細胞におけるTNFとRANKの発現も誘導します。
ACPAは関節リウマチにおける骨量減少の媒介に役割を果たしていると考えられています。ACPA陽性関節リウマチの人はACPA陰性の人に比べて骨密度が有意に低いことがわかっています。ACPAは、破骨細胞の表面にあるシトルリン化ビメンチンに結合してこれらの骨吸収細胞の分化と活性化を促進し、全身の骨量減少に寄与する可能性があります。
関節リウマチにおける全身の骨密度低下は、慢性炎症、グルココルチコイドの使用、ビタミンD欠乏症、閉経(女性ホルモン低下)、身体活動の低下(サルコペニア)など、さまざまな要因が組み合わさって起こると考えられています。メタ分析の結果、関節リウマチにおけるグルココルチコイドは、特に高用量の場合、骨粗鬆症のリスクを高める可能性があることが示されました。
9. リウマチ性血管炎
リウマチ性血管炎は、関節リウマチのまれな関節外症状の1つであり、さまざまな臓器の中小血管に影響を及ぼす可能性があります。最も一般的には皮膚に爪郭梗塞、紫斑、指虚血、網状皮斑などを引き起こしたり、末梢神経系に影響を及ぼしたりします。組織学的には、白血球壊死または血管壁の細胞浸潤に認め、3層を超える細胞層に及ぶ血管周囲細胞浸潤が特徴的です。リウマチ性血管炎患者はRF陽性およびACPA陽性です??。血管炎症状は、関節の炎症が低い関節リウマチの診断から10~14年後に現れ、関節障害とは無関係であることを示しています??。特定のHLA-DRB1 SE遺伝子型(0401/*0401、*0401/*0404、*0101/*0401など)はリウマチ性血管炎に関連していることが示されています。喫煙はリウマチ性血管炎の危険因子で、内皮機能不全、血管閉塞につながる可能性があります。リウマチ性血管炎患者の補体レベルが低いことから、血液中のRF免疫複合体がC3に結合し、血管壁への免疫複合体の沈着と補体の活性化が炎症と破壊につながることが示唆されます。
10. 腎病変
関節リウマチにおける腎症状はまれであり、特に関節リウマチ治療の最近の進歩により疾患コントロールが改善され、関節リウマチ患者の腎障害(アミロイドーシスなど)の発生率がさらに低下してきています。しかし、以前に使用された疾患修飾性抗リウマチ薬(DMARD)と非ステロイド性抗炎症薬の多用は、関節リウマチ患者の腎疾患の一因となっています。関節リウマチ患者の約7~10%に腎機能障害がありますが、通常、関節リウマチが直接の原因ではありません。ある研究では、関節リウマチ患者の慢性腎臓病は、疾患活動性や持続期間ではなく、高齢、脂質異常症、血清尿酸などの従来の心血管リスクに関連していることを示しています。さらに、関節外疾患(リウマチ結節を除く)の存在も関節リウマチ患者の腎障害に関連しています。遺伝的素因に関しては、血清学的HLA-DR15と遺伝子型HLADRB1*1501が関節リウマチ患者の腎障害と関連していることが観察されております。関節リウマチ患者の腎生検で最も一般的な組織学的所見は、メサンギウム糸球体腎炎、膜性腎症、および二次性アミロイドーシスです。関節リウマチ患者のIL-6レベルが高いことも、メサンギウム糸球体腎炎の病態に関与している可能性があります。関節リウマチ患者の膜性腎症は、ブシラミン、D-ペニシラミン、金などの特定のDMARDに関連しており、特定の関節リウマチ関連メカニズムによって直接引き起こされるのではないことを示唆しています。対照的に、二次性アミロイドーシスは、制御されていない関節リウマチ活動によって引き起こされ、肝細胞による血清アミロイドA産生を引き起こす炎症性サイトカインの高レベルにつながります。その後、血清アミロイドAが腎臓に沈着し、特に遺伝的に素因のある人で腎臓機能障害を引き起こします。
11. 結論
関節リウマチの臨床症状は 関節外症状の影響を大きく受け、患者の生活の質と死亡率に悪影響を及ぼします。関節リウマチの治療を進歩させ、患者の転帰を改善するには、関節外症状の病因をより深く理解するためのさらなる研究が必要です。この総説では、いくつかの頻繁な 関節外症状 の病態生理学的メカニズムについて説明しましたが、関節リウマチの異質性、および引用した研究の一部が小グループ、モデル、または in vitro 実験を使用しているという事実は、この総説の明らかな限界を示しています。関節リウマチに対する効果的な治療を提供し、転帰を改善するには、患者の関節外症状を徹底的に評価することが不可欠です。12. 文献
1)Pathogenesis of Extraarticular Manifestations in Rheumatoid Arthritis-A Comprehensive Review. Biomedicines 2023, 11, 1262.https://doi.org/10.3390/biomedicines11051262
<<2024年7月17日作成>>
★メニュー
┣当院のご案内┣アクセス
┣院長ヒストリー
┣リウマチ科とは
┣新型コロナウイルス対策
┣関節リウマチ
┣全身性エリテマトーデス
┣多発性筋炎/皮膚筋炎
┣強皮症
┣強直性脊椎炎
┣乾癬性関節炎
┣ベーチェット病
┣ドライマウス
┣シェーグレン症候群
┣IgG4
┣血管炎
┣更年期に見られる関節症状について
┣高齢者に見られる関節・筋肉症状について
┣骨粗鬆症
┣かぜ
┣インフルエンザ
┣肺炎
┣喘息について
┣プライマリケアにおける救急疾患の落とし穴
┣睡眠
┣痛みについて
┣心理療法
┣ストレスについて
┣トラウマ・PTSDについて
┣運動脳 その後
┣京都の桜、紅葉
┣私の山歩き
┣Dr. 後藤のミネソタ紀行
┣個人情報保護について
┗リンク
