関節リウマチの病態生理(関節炎)
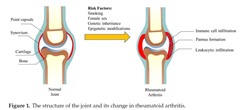
滑膜炎は関節リウマチの特徴であり、関節リウマチの滑膜組織の病理では、滑膜の増殖、血管新生、多様な炎症細胞の浸潤が指摘されています。通常、滑膜は、1層または2層の滑膜細胞からなる薄い膜状の構造です。滑膜は、Fibroblast-Like Synovial (FLS)とMacrophage-Like Synovial (MLS)がほぼ同じ割合で構成さ れています。MLS に関する研究はあまりありませんが、健康な滑膜組織では、FLSは滑液の生成を促進し、関節腔に血漿タンパク質を提供することで軟骨を保護します。FLSはまた、コラーゲンなどのマトリックス成分と細胞外マトリックス分解酵素を生成することによって滑膜の恒常性を維持します。
関節リウマチでは、滑膜が炎症を起こして、滑膜細胞の層が10~15層まで厚くなります。関節リウマチの炎症条件下では、FLSは無害な間葉系細胞からパンヌスとして知られる破壊的で攻撃的な腫瘍様細胞へと大きく変化します。形質転換されたFLSは、関節リウマチの進行において主導的な役割を果たし、アポトーシスに対する感受性の低下、接着分子の過剰発現、サイトカイン、ケモカイン、およびマトリックスメタロプロテイナーゼの異常産生を特徴とします。接着分子の過剰発現、サイトカイン、ケモカインの異常産生によりさまざまな細胞を滑膜周辺に集積させます。集積してきた浸潤細胞には、T細胞およびB細胞、形質細胞、形質芽細胞、マクロファージ、樹状細胞、および場合によってはマスト細胞やナチュラル キラー細胞が含まれます。好中球はリウマチの滑膜にはまばらですが、滑液中に多く存在するとされます。
文献2]
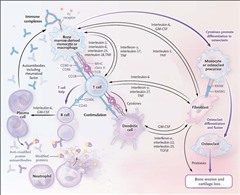
活動性関節リウマチでは、軟骨、靱帯、腱の細胞外基質が、滑膜細胞、特にFLSや軟骨細胞自体によって産生されるプロテイナーゼによって破壊されます。マクロファージ、T細胞など分泌するTNFαやIL-1βの炎症性サイトカインは、滑膜細胞を直接活性化して、滑膜細胞は軟骨や関節の破壊に寄与するマトリックス メタロプロテイナーゼ(コラゲナーゼ、ストロメライシン、ゼラチナーゼなど)を生成します。さらに、増殖した滑膜細胞はIL-6を産生し、滑膜の炎症をさらに活性化します。
骨の 破壊には破骨細胞の作用が必要であり、破骨細胞はRANKLの受容体活性化因子と炎症誘発性サイトカイン、特にTNFとIL-6の複合作用によって分化します。関節リウマチにおける骨量減少を促進する最も重要なRANKLの供給源はFLSですが、特定のT細胞およびB細胞サブセットもRANKLを生成します。炎症を起こした滑膜細胞は、炎症性サイトカインを産生し、RANKL発現細胞を増加させ、破骨細胞形成を誘導します。破骨細胞は骨に付着し、骨からミネラルを浸出させる酸性環境を形成し、骨基質を分解するカテプシンKなどの酵素を生成します。RANKLと炎症誘発性サイトカインが血中に入り、全身の骨量減少を引き起こし、骨粗鬆症を促進します。
文献1]
滑膜内の細胞間相互作用は、関節リウマチの発症の重要な要素です。樹状細胞、マクロファージ、B 細胞などは、修飾(シトルリン化など)タンパク質を含む抗原をT細胞に提示して、これらの細胞を活性化し、分化を誘導します。これによりサイトカインが産生され、単球、マクロファージ、FLSなどの隣接する他の細胞が活性化され、さらなる炎症誘発性サイトカインや因子が産生されます。RANKLはFLSによって産生されますが、特定のT細胞およびB細胞サブセットによっても産生され、単球の骨吸収破骨細胞への分化を誘導します。骨の破骨細胞の分解は関節リウマチ患者に見られる関節びらんを引き起こし、炎症性サイトカインによって誘導されるプロテアーゼは軟骨の喪失とX線撮影による関節腔の狭小化を引き起こします。
2]New Targets and Strategies for Rheumatoid Arthritis: From Signal Transduction to Epigenetic Aspect. Biomolecules 2023, 13, 766. https://doi.org/10.3390/biom13050766
3]Signaling pathways in rheumatoid arthritis: implications for targeted therapy. Signal Transduction and Targeted Therapy 2023 8:68. https://doi.org/10.1038/s41392-023-01331-9
≪2024年3月21日作成≫
関節リウマチでは、滑膜が炎症を起こして、滑膜細胞の層が10~15層まで厚くなります。関節リウマチの炎症条件下では、FLSは無害な間葉系細胞からパンヌスとして知られる破壊的で攻撃的な腫瘍様細胞へと大きく変化します。形質転換されたFLSは、関節リウマチの進行において主導的な役割を果たし、アポトーシスに対する感受性の低下、接着分子の過剰発現、サイトカイン、ケモカイン、およびマトリックスメタロプロテイナーゼの異常産生を特徴とします。接着分子の過剰発現、サイトカイン、ケモカインの異常産生によりさまざまな細胞を滑膜周辺に集積させます。集積してきた浸潤細胞には、T細胞およびB細胞、形質細胞、形質芽細胞、マクロファージ、樹状細胞、および場合によってはマスト細胞やナチュラル キラー細胞が含まれます。好中球はリウマチの滑膜にはまばらですが、滑液中に多く存在するとされます。

文献2]
活動性関節リウマチでは、軟骨、靱帯、腱の細胞外基質が、滑膜細胞、特にFLSや軟骨細胞自体によって産生されるプロテイナーゼによって破壊されます。マクロファージ、T細胞など分泌するTNFαやIL-1βの炎症性サイトカインは、滑膜細胞を直接活性化して、滑膜細胞は軟骨や関節の破壊に寄与するマトリックス メタロプロテイナーゼ(コラゲナーゼ、ストロメライシン、ゼラチナーゼなど)を生成します。さらに、増殖した滑膜細胞はIL-6を産生し、滑膜の炎症をさらに活性化します。
骨の 破壊には破骨細胞の作用が必要であり、破骨細胞はRANKLの受容体活性化因子と炎症誘発性サイトカイン、特にTNFとIL-6の複合作用によって分化します。関節リウマチにおける骨量減少を促進する最も重要なRANKLの供給源はFLSですが、特定のT細胞およびB細胞サブセットもRANKLを生成します。炎症を起こした滑膜細胞は、炎症性サイトカインを産生し、RANKL発現細胞を増加させ、破骨細胞形成を誘導します。破骨細胞は骨に付着し、骨からミネラルを浸出させる酸性環境を形成し、骨基質を分解するカテプシンKなどの酵素を生成します。RANKLと炎症誘発性サイトカインが血中に入り、全身の骨量減少を引き起こし、骨粗鬆症を促進します。

文献1]
滑膜内の細胞間相互作用は、関節リウマチの発症の重要な要素です。樹状細胞、マクロファージ、B 細胞などは、修飾(シトルリン化など)タンパク質を含む抗原をT細胞に提示して、これらの細胞を活性化し、分化を誘導します。これによりサイトカインが産生され、単球、マクロファージ、FLSなどの隣接する他の細胞が活性化され、さらなる炎症誘発性サイトカインや因子が産生されます。RANKLはFLSによって産生されますが、特定のT細胞およびB細胞サブセットによっても産生され、単球の骨吸収破骨細胞への分化を誘導します。骨の破骨細胞の分解は関節リウマチ患者に見られる関節びらんを引き起こし、炎症性サイトカインによって誘導されるプロテアーゼは軟骨の喪失とX線撮影による関節腔の狭小化を引き起こします。
文献
1]Rheumatoid Arthritis - Common Origins, Divergent Mechanisms. N Engl J Med 2023;388:529-42. DOI: 10.1056/NEJMra21037262]New Targets and Strategies for Rheumatoid Arthritis: From Signal Transduction to Epigenetic Aspect. Biomolecules 2023, 13, 766. https://doi.org/10.3390/biom13050766
3]Signaling pathways in rheumatoid arthritis: implications for targeted therapy. Signal Transduction and Targeted Therapy 2023 8:68. https://doi.org/10.1038/s41392-023-01331-9
≪2024年3月21日作成≫
★メニュー
┣当院のご案内┣アクセス
┣院長ヒストリー
┣リウマチ科とは
┣新型コロナウイルス対策
┣関節リウマチ
┣全身性エリテマトーデス
┣多発性筋炎/皮膚筋炎
┣強皮症
┣強直性脊椎炎
┣乾癬性関節炎
┣ベーチェット病
┣ドライマウス
┣シェーグレン症候群
┣IgG4
┣血管炎
┣更年期に見られる関節症状について
┣高齢者に見られる関節・筋肉症状について
┣骨粗鬆症
┣かぜ
┣インフルエンザ
┣肺炎
┣喘息について
┣プライマリケアにおける救急疾患の落とし穴
┣睡眠
┣痛みについて
┣心理療法
┣ストレスについて
┣トラウマ・PTSDについて
┣運動脳 その後
┣京都の桜、紅葉
┣私の山歩き
┣Dr. 後藤のミネソタ紀行
┣個人情報保護について
┗リンク
