関節リウマチとエピジェネティックス
Epigenetic Regulation in RA
エピジェネティクス(EPIGENETICS)とは、DNA配列の変化を伴わない染色体構造の変化を特徴とし、遺伝子発現の調節を起こす事を言います。エピジェネティクスにより、ある遺伝子はONとなり、別の遺伝子はOFFとなります。Histone Modification(ヒストン修飾)、DNA Methylation(DNAメチル化)、Micro RNAは、エピジェネティックな変化の例です。エピジェネティックな変化が関節リウマチの発症と関連があるという報告が多々あります。幸いなことに、これらのエピジェネティックな修飾は元に戻すことができます。エピジェネティクスの研究は、関節リウマチの治療法の開発に新たな道を切り開きました。エピジェネティックな修飾は関節リウマチの発症と進行において重要な役割を果たすことが示されており、これらの修飾を標的とする薬剤はこの疾患の動物モデルで有望な結果を示しています。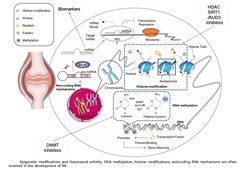
文献2]より
Histone Modification
最近の研究では、ヒストン修飾が関節リウマチの発症と進行に関与している可能性があることが示されています。ヒストンは細胞核内でDNAをパッケージングしてヌクレオソームを形成するのを助けるタンパク質であり、さらに細胞の核内で染色体を形成する元になります。ヒストン修飾には、ユビキチン化、アセチル化、メチル化、リン酸化、脱アミド化、ADPリボシル化などが含まれます。ヒストン修飾により、DNAが転写因子にどれだけアクセスできるかが制御(遺伝子発現を増加させたり減少させたり)されます。現在、多くの研究がヒストン修飾を複数の疾患、特にがん研究の分野に適用しており、これらの疾患を治療するための新しいアイデアを提供しています。ヒストンデアセチラーゼ (histone deacetylases HDAC:ヒストンを脱アセチル化する酵素) が 関節リウマチの発症と進行に関与している可能性があると報告されています。ある研究では、関節リウマチ患者の滑膜組織ではHDACが増加しており、HDACを阻害すると炎症反応が軽減できることが示されています。HDAC阻害剤は、TNF-αやIL-6 などの炎症誘発性サイトカインの産生を減少させ、制御性T細胞の活性を増加させることが示されており、これは関節リウマチにおける免疫応答の抑制に役立ちます。HDAC6 阻害剤 CKD-506およびCKD-L および HDAC6 阻害剤 NKHDAC1 などのいくつかの HDAC阻害剤は、関節リウマチの治療法として現在前臨床研究が進行中です。

文献2]より
DNA Methylation
DNAメチル化は、DNA配列を変えることなく、DNA methyltransferase (DMNT)の作用により、ゲノム内のCpGアイランドにメチル基が結合することです。CpGアイランドは、DNAメチル化が発生する最も一般的な領域で、そのほとんどはプロモーター領域に位置します。一般に、遺伝子プロモーター領域の過剰メチル化により転写因子の結合が妨げられ、転写抑制が引き起こされます。関節リウマチ患者の末梢血単核球では DNAメチル化レベルが低いことが報告されています。DNAメチル化の減少は、増殖性の高い組織でよく見られ、DNAの低メチル化により、細胞外マトリックスタンパク質、成長因子/受容体、マトリックス分解酵素、接着分子の発現が増加します。ある研究では、Peptidylarginine deiminase type 4 (PADI4) のDNAメチル化レベルが、健常対照と比較して関節リウマチ患者では有意に低いことが判明しました。 PADI4はタンパク質のシトルリン化に関与しており、関節リウマチの発症における遺伝的危険因子であると考えられています。一方、関節リウマチ患者から分離された末梢血単核球では、DNMT阻害剤は抗炎症性サイトカインIL-10の発現を増加させました。したがって、DNMT阻害剤が潜在的な関節リウマチ治療薬として提案されています。 しかし、DNAメチル化と関節リウマチの発生および発症との関係は複雑であり、さらなる研究が必要です。

文献2]より
Micro RNA (miRNA)
Micro RNA(miRNA)は、非コーディングRNAの修飾において重要な位置を占めています。miRNAとその標的messenger RNAが結合し複合体を形成すると、転写抑制またはmRNA の減衰が起こります。miRNAは多くの病気、特に癌の発生と進行に関与していると考えられています。関節リウマチ患者ではmiRNA発現にmiRNAの種類によって違いがみられます。たとえば、関節リウマチ患者の末梢血単球では、さまざまなmiRNA (miR-16、miR-103a、miR-132、miR-145、miR-146a、miR-155、miR-203) がupregulateされている一方で、miRNA (miR-21、miR-125b、miR548a)はdown-regulateされていることが報告されています。miR-203は関節リウマチの滑膜細胞でupregulateされ、MMP-1およびIL-6の生成を促進することによって関節リウマチを誘発します。miRNAを標的とすることも、関節リウマチの潜在的な治療戦略として浮上しています。 たとえば、miR-155やmiR-146a を標的とする治療法です。関節リウマチ治療におけるmiRNAの役割を完全に解明し、この疾患に対するmiRNAベースの治療法を開発するには、さらなる研究が必要です。

文献1]より
miRNA発現レベルの変化は、関節リウマチ治療に対する治療反応を予測するための潜在的なバイオマーカーとして提案されています。たとえば、miR-16、miR-132、miR-22、miR-155、miR-146a は、メトトレキサート治療反応バイオマーカーとして記載されています。抗TNF-α療法後に、miRNA-23-3p、miRNA-16-5p、miRNA125b-5p、miRNA-146A-5P、miRNA-126-3p、miRNA-223-3p は、有意にupregulateされることが判明しました。 興味深いことに、抗TNF-α療法有効例のみがこれらのmiRNAの増加を示し、CRP、リウマチ因子、TNF-α、IL-6、IL-17の減少と一致していました。
文献
1]New Targets and Strategies for Rheumatoid Arthritis: From Signal Transduction to Epigenetic Aspect. Biomolecules 2023, 13, 766. https://doi.org/10.3390/biom130507662]Signaling pathways in rheumatoid arthritis: implications for targeted therapy. Signal Transduction and Targeted Therapy 2023 8:68. https://doi.org/10.1038/s41392-023-01331-9
≪2024年6月10日作成≫
★メニュー
┣当院のご案内┣アクセス
┣院長ヒストリー
┣リウマチ科とは
┣新型コロナウイルス対策
┣関節リウマチ
┣全身性エリテマトーデス
┣多発性筋炎/皮膚筋炎
┣強皮症
┣強直性脊椎炎
┣乾癬性関節炎
┣ベーチェット病
┣ドライマウス
┣シェーグレン症候群
┣IgG4
┣血管炎
┣更年期に見られる関節症状について
┣高齢者に見られる関節・筋肉症状について
┣骨粗鬆症
┣かぜ
┣インフルエンザ
┣肺炎
┣喘息について
┣プライマリケアにおける救急疾患の落とし穴
┣睡眠
┣痛みについて
┣心理療法
┣ストレスについて
┣トラウマ・PTSDについて
┣運動脳 その後
┣京都の桜、紅葉
┣私の山歩き
┣Dr. 後藤のミネソタ紀行
┣個人情報保護について
┗リンク
