mRNAワクチンの安全性について
mRNAワクチンの安全性に対して問題を提起する論文(mRNA: Vaccine or Gene Therapy? The Safety Regulatory Issues. Int. J. Mol. Sci. 2023, 24, 10514. https://doi.org/10.3390/ijms241310514)についてまとめました。
略語FDA:Food and Drug Administration、米国食品医薬品局、米国における医薬品の管理組織EMA:European Medicines Agency、欧州医薬品庁、EUにおける医薬品の管理組織
COVID-19 mRNAワクチンは、パンデミックによって生じた緊急性に応じて迅速に開発され、承認されました。販売された時点では具体的な規制は存在していませんでした。パンデミックの緊急事態(WHOは2023年5月初旬にCOVID-19パンデミックの緊急段階の終了を宣言しました)が過ぎた今、mRNAワクチンの安全性の問題を検討する時が来ました。
1)mRNAワクチンは遺伝子治療製品として見なされていなかった。
COVID-19 mRNAワクチンは、市販された最初のmRNAワクチンです。新しいクラスのワクチンであるmRNAワクチンは、新しい技術に基づいているため、従来のワクチンよりも多くの管理を受ける必要があります。mRNAワクチンの作用機序からすれば、遺伝子治療製品に分類されるはずです。mRNAは、ワクチン接種者の細胞に抗原を生成させ、抗体の生成を誘導することを目的とした核酸です。この作用機序は、規制当局の遺伝子治療製品 の定義と正確に一致しています。
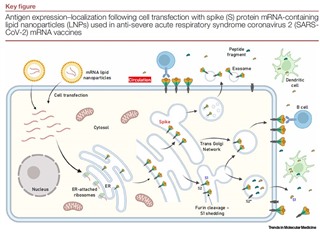 図 文献2)より
図 文献2)より
しかし、感染症に対するワクチンとしてのmRNAは、米国およびEUの規制により遺伝子治療製品規制から除外されています(表)。この除外には科学的または倫理的な正当性が示されておらず、規制には矛盾が残っています。遺伝子治療製品に必要な管理の一部は、COVID-19 mRNAワクチンには求められませんでした。これは、COVID-19 mRNAワクチンの急速な開発を必要としたパンデミック緊急事態のためと考えられます。実際、モデルナ社とビオンテック社(ファイザーワクチンの製造元)が自社製品が遺伝子治療薬として規制されると予想していました。モデルナ社は、2020年の証券取引委員会への提出書類で、「現在、mRNAはFDAによって遺伝子治療薬とみなされている」と認めていました。さらに、ビオンテックの創設者であるウグル・サヒン氏は、2014年の記事で「mRNA薬の分類は、生物学的製剤、遺伝子治療薬、または体細胞治療薬であると予想される」と述べていました。COVID-19 mRNAワクチンは、世界の健康な人口の大多数を対象とした製品であり、希少疾患や癌を患う少数の稀な人々を対象とした遺伝子治療製品よりも厳しい規制の対象となるべきだと異議を唱える人もいるかもしれません。
表 遺伝子治療とワクチン規制の歴史
| 年 | 規制機関 | 規則 |
|---|---|---|
| 1998 | FDA | 予防ワクチンとして使用される遺伝物質を移送するために使用される組み換えDNA物質は、遺伝子治療のガイダンスの対象外である。RNAベースの遺伝子治療はまだ想定されていなかったため、RNA については言及されていない。 |
| 2009 | EMA | 感染症に対するワクチンは 遺伝子治療製品の規制から除外される。倫理的または科学的な正当性は提供されていない。 |
| 2013 | FDA | 遺伝子治療製品の規制は感染症ワクチンには適用されないこととなった。DNAプラスミドに適用。 |
| 2015 | EMA | 感染症ワクチンは遺伝子治療製品として分類されないことを確認した。倫理的または科学的な正当性は示されていない。 |
1-1)mRNAワクチンの品質管理
COVID19 mRNAワクチンは遺伝子治療製品と認定されていないため、製品品質に関しては、十分な検査は行われていませんでした。たとえば、製品の純度についていえば、EMAはヒト用製品に95%の純度を要求していますが、ファイザーの最終製品の純度は製造プロセスによって変化し、製品の純度は市販時点で95%を大きく下回っており、合格基準は50%であったとのことです。毒物であるエンドトキシンレベルの数値で提供されませんでした。製品に含まれる不純物に関するデータも提供されていません。COVID19 mRNAワクチンに関連する不純物は安全性の問題を引き起こす可能性があります。mRNAの製造に使用されたテンプレートからの汚染DNAの量を再評価する必要があります。mRNA生成のテンプレートとして使用されるDNAプラスミドには、抗生物質耐性遺伝子(カナマイシン耐性遺伝子)が含まれています。mRNAワクチンの中にこのDNAプラスミド(カナマイシン耐性遺伝子)が混入している可能性があり、耐性遺伝子がヒトの腸内細菌または体細胞に組み込まれると抗生物質耐性を引き起こす懸念があります。COVID-19 mRNAワクチンが遺伝子治療製品の制御の対象であった場合、これらの検査は実施されていたでしょう。しかし、COVID19ワクチンに求められる管理は、製品の純度と品質に関して完全に満足のいくものではありませんでした。
1-2)投与されるmRNAと細胞内の遺伝子(DNA)との相互作用は十分には調べられていない
mRNAによる腫瘍形成、卵子・精子・胎児への毒性(遺伝毒性)のリスクを評価する試験も必要とされますが、これらは実施されていません。遺伝子治療製品の長期安全性モニタリングは数年にわたって必要ですが、COVID19 mRNAワクチンの場合、数週間しかモニタリングは実施されませんでした。実際、COVID-19 mRNAワクチン接種後に新たながんが発生したり、がんが再活性化したりした症例が報告されています。その他、骨髄抑制や再生不良性貧血、脳炎、脱髄性神経疾患、リウマチ性疾患なども報告されています。ワクチンの接種は2回のみと計画されていたため、反復毒性は十分に研究されませんでした。mRNAがどの臓器に集まるのか、排泄後の環境への影響の検査も行われていませんでした。市販後調査では、多くの臓器で数週間にわたってmRNA が分布し、持続することが示されています。mRNAの産物であるスパイク蛋白も数週間血液中を循環し、ワクチン接種後3週間で死亡した人の脳と心臓でスパイク蛋白が発見されました。スパイク蛋白はワクチン接種後100日まで皮膚病変で発見されました。市販後の研究では、mRNAが母乳に移行し、母乳で育てられた赤ちゃんに悪影響を与える可能性があることが示されています。したがって、製造業者が実施した前臨床研究は、この広範な生体内分布と持続性を検出できなかったため、薬物動態の観点からは不完全であると思われます。さらに、ワクチン接種後に第三者への伝達(水平感染)の可能性を調査するか、またはこれを行わない正当な理由を示す必要があります。
1-3)COVID19 mRNAワクチンから作られるスパイク蛋白は体にとって有害である
スパイクタンパク質が大量に産生され、重症COVID-19患者の体内を循環している量を超える場合もあることが報告されています。スパイク濃度を比較すると、重症COVID-19では、濃度の中央値は50 pg/mLで、最大値は1000 pg/mLです。mRNAワクチン接種後、通常は150 pg/mL(重症COVID-19の3倍)までの濃度が観察されますが、ワクチン誘発性血小板減少症の患者では10000 pg/mLに達することもあります。スパイク蛋白は血管に悪影響を及ぼし、血栓症や心筋炎を起こす原因となります。
2)mRNAワクチンはワクチンとして見なされていなかった。
欧州の規制によれば、ワクチンは感染性因子(細菌やウイルスなど)に対する能動免疫を誘導することができる抗原(蛋白質、糖質など)を含んでいる事とされています。EMAによれば、COVID-19ワクチン(モデルナ、ファイザー)の有効成分はmRNAであり、抗原ではありません。したがって、欧州およびフランスの薬局方によれば、mRNAは抗原を含まないためワクチンとはみなされないことになります。2020年、WHOはmRNAワクチンに関する規制が明確でないことを指摘しました。この規制問題を解決するため、WHOは2020年12月20日に、ワクチンの製造と管理、非臨床評価を含むmRNAワクチンの品質、安全性、有効性の評価に関するガイダンス文書の草案を発表しました。なぜなら、WHOは、COVID-19 mRNAワクチンの製造に関する詳細な情報が入手できなかったからです。2023年から新しいワクチンの臨床評価を規制するために設計されたEMA文書では、mRNAワクチンについては言及されておらず、ワクチンには抗原が含まれていることが依然として明記されているため、この文書は抗原を含まないmRNAワクチンには適用されません。
3)mRNAワクチンはプロドラッグとして見なされていなかった。
さらに、その作用機序から、mRNAワクチンはプロワクチンとみなすことができます。これは、投与後に生物によって薬理学的に活性な薬物に変換される薬物を指すプロドラッグという言葉をモデルにした造語です。実際、mRNAの原理によれば、これはワクチン接種を受けた人の細胞によってタンパク質に変換されなければなりません。FDAによると、mRNAワクチンはプロドラッグに相当し、細胞によって活性薬物に変換される物質と規定されていました。このプロドラッグ特性は、ワクチンに適用される規制に加えて追加の規制が必要な可能性があります。しかし、FDAもEMAも、COVID-19 mRNAワクチンのプロドラッグとしても規制については言及していません。すなわち、プロドラッグとして必要な管理を受けていないという事です。
結語
COVID-19 mRNAワクチンは、新しいタイプの製品であったにもかかわらず、遺伝子治療製品とも、ワクチンとも、プロドラッグとも見なされていないことにより、本来であれば数年かけて安全性について検討されるべき規制をすりぬけて、数週間で承認されました。mRNAワクチンに対する管理が不十分なことで生じる安全性の問題は今後さらに重要となります。メーカーはインフルエンザワクチンを皮切りに、特定の「古典的な」ワクチンをmRNAワクチンに置き換えることを計画しているからです。実際、サノフィは初のmRNAベースの季節性インフルエンザワクチンの臨床試験を開始しており、モデルナは多くのmRNAワクチン(COVID-19、インフルエンザ、ヒトメタニューモウイルス、パラインフルエンザ、RSウイルス、サイトメガロウイルス、EBウイルス、水痘、ヘルペスウイルス、HIV、ジカウイルス、ニパウイルス)の臨床試験を行っております。今からでも遅くないので、COVID-19 mRNAワクチンの安全性について再度詳細に検討することが必要と思われます。すなわち、mRNAが長期にわたって体内に発現されること、mRNAが遺伝子へ組み込まれること、生殖細胞への伝達、精子への影響、胚/胎児および周産期毒性ならびに遺伝毒性、腫瘍形成性、水平伝播(すなわち、人から人への伝播)について評価されるべきです。市販後の徹底したワクチン安全性監視も実施すべきです。パンデミックの状況ではない時期に開発される将来のmRNAワクチンには、これらの管理が必要になると予想されます。
文献
1)mRNA: Vaccine or Gene Therapy? The Safety Regulatory Issues. Int. J. Mol. Sci. 2023, 24, 10514. https://doi.org/10.3390/ijms2413105142)Adverse effects of COVID-19mRNA vaccines : the spike hypothesis. Trends in Molecular Medicine, 2022 : 542-554 https://doi.org/10.1016/j.molmed.2022.04.007
<2024年10月18日作成>
関連ページ
- 新型コロナウイルスQ&A
- 新型コロナウイルスとリウマチ性疾患
- 新型コロナウイルスとリウマチ性疾患について説明します。
- 新型コロナワクチン接種後のリウマチ性疾患患者の影響
- 新型コロナワクチン接種後のリウマチ性疾患患者の影響について
- 新型コロナmRNAワクチンの有害事象
